
【题目】25℃时用0.10mol/L的KOH溶液滴定20.00mL0.10 mol/L的H2C2O4溶液,滴定过程中溶液的pH随KOH溶液体积变化如图所示(忽略滴定过程中溶液的温度变化和体积变化),下列说法错误的是( )
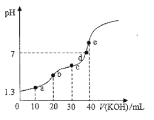
A. 25℃时H2C2O4的电离常数Ka1=10-1.6
B. b点满足关系:c(H2C2O4)+c(H+)=c(OH-)+c(C2O42-)
C. c点溶液中粒子浓度大小顺序:c(K+)>c(C2O42-)>c(HC2O4)>c(H2C2O4)
D. 从a点到e点水的电离程度逐渐增大
【答案】A
【解析】
A、0.10 mol/L的H2C2O4溶液pH为13,说明草酸的一级电离程度较大,c(HCO4-)明显小于0.10mol/L,因此H2C2O4的电离常数Ka1大于10-16,选项A错误;
B、b点溶液是KHC2O4溶液,质子守恒关系式是c(H2C2O4)+c(H+)=c(OH-)+c(C2O42-),选项B正确;
C、c点是等物质的量浓度的KHC2O4和K2C2O4的混合溶液,此时溶液显酸性,因此HCO4-的电离程度> C2O42-的水解程度> HCO4-的水解程度,因此溶液中c(K+)> c(C2O42-)>c(HC2O4)>c(H2C2O4),选项C正确;
D、从a点到e点随着草酸不断被中和,同时不断生成可以水解的盐,水的电离程度逐渐增大,选项D正确。
答案选A。


科目:高中化学 来源: 题型:
【题目】现有铁、碳两种元素组成的合金,某实验小组为了研究该合金的性质并测定该合金中碳的质量分数,设计了如图实验方案和实验装置。(已知SO2能与酸性KMnO4反应生成硫酸盐)

I.探究该合金的某些性质:
(1)取ag合金粉末放入蒸馏烧瓶,并加入足量浓H2SO4,A、B中均无明显现象,原因是__;
(2)点燃酒精灯一段时间后,A中剧烈反应,请写出此时合金中成分碳参与的化学反应方程式__;
(3)装置D的作用是__;装置E的作用是__。
II.测定样品中碳的质量分数:
(4)装置F的作用__;
(5)若反应前后E装置的质量分别是m1和m2,则合金中碳的质量分数是__,若没有连接D装置会使测定结果__(填“偏大”“偏小”“无影响”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA为阿伏加德罗常数的值.下列说法正确的是( )
A. 高温下,0.2 mol Fe与足量水蒸气反应,生成的H2分子数目为0.3NA
B. 室温下,1 L pH=13的NaOH溶液中,由水电离的OH﹣离子数目为0.1NA
C. 氢氧燃料电池正极消耗22.4 L(标准状况)气体时,电路中通过的电子数目为2NA
D. 5NH4NO3![]() 2HNO3+4N2↑+9H2O反应中,生成28 g N2时,转移的电子数目为3.75NA
2HNO3+4N2↑+9H2O反应中,生成28 g N2时,转移的电子数目为3.75NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某温度下,相同pH的盐酸和醋酸分别加水稀释至平衡,pH随溶液体积变化的曲线如下图所 示。据图判断正确的是

A. Ⅱ为盐酸稀释时的pH变化曲线
B. b点溶液的导电性比c点溶液的导电性强
C. a点KW的数值比c点KW的数值大
D. b点酸的总浓度大于a点酸的总浓度
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】圣路易斯大学研制的新型乙醇燃料电池, 用能传递质子(H+)的介质作溶剂, 反应为C2H5OH+3O2→2CO2+3H2O,下图是该电池的示意图,下列说法正确的是( )

A.a极为电池的正极
B.电池正极的电极反应为:4H+ + O2 + 4e-=== 2H2O
C.电池工作时电流由a极沿导线经灯泡再到b极
D.电池工作时,1mol乙醇被氧化时就有6 mol电子转移
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硫酸是当今世界上最重要的化工产品之一,硫酸在生产中具有广泛的应用。
(1)某同学用如图所示的装置,完成铜与浓硫酸反应的实验:

①试管II中的现象是___。
②试管Ⅰ中发生反应的化学方程式是___。
③请你指出该实验装置的不足之处___。
(2)在实际应用中,人们常根据需要,把浓硫酸稀释成不同浓度的稀硫酸。现用18.4mol·L-1的浓H2SO4配制100mL1.00mol·L-1的稀H2SO4。
①用量筒量取浓硫酸的体积是___mL。
②下列操作会使所配溶液浓度偏低的是___。
A.将溶液转移到未干燥的容量瓶中
B.转移时,忘记洗涤烧杯和玻璃棒
C.将未冷却的溶液转移到容量瓶中
D.定容时,仰视刻度线
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】磺酰氯(SO2C12)是有机合成领域常用的氯化剂、磺化剂、氯磺化剂,熔点-54.1℃,沸点69.1℃,在潮湿空气中会产生酸雾,高温下容易分解。某化学小组用下图所示装置制取磺酰氯,反应原理是:SO2(g)+C12(g)=SO2C12 (1)△H=-97.3kJ/mol,请回答相关问题。

(1)仪器组装好以后首先要进行的操作是____。
(2)装置E的仪器名称是___,所装药品是____。
(3)若缺少装置B,三颈烧瓶中会发生的主要副反应化学方程式是____(任写一个)。装置B更换为某装置后可起到同样的作用,该装置可以是____。
(4)通过气体流量计测得通入Cl2的体积折合成标准状况为3.36L(SO2足量),最终得到的SO2C12质量为8.1g,则产率___。下列措施能提高SO2C12产率的是___。(填选项序号)
a.加快通入氯气的速率
b.三颈烧瓶温度过高时适当冷却
c.先打开分液漏斗活塞并通入氯气再通入冷凝水
(5)某同学在实验过程中不小心将SO2C12与H2SO4混合在一起,分离该混合物的方法是___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室中有一未知浓度的稀盐酸,某学生用0.10 mol·L-1 NaOH标准溶液进行测定盐酸的浓度的实验。取20.00 mL待测盐酸放入锥形瓶中,并滴加2~3滴酚酞作指示剂,用自己配制的NaOH标准溶液进行滴定。重复上述滴定操作2~3次,记录数据如下。请完成下列填空:
实验编号 | 待测盐酸的体积(mL) | NaOH溶液的浓度(mol·L-1) | 滴定完成时,NaOH溶液滴入的体积(mL) |
1 | 20.00 | 0.10 | 24.18 |
2 | 20.00 | 0.10 | 23.06 |
3 | 20.00 | 0.10 | 22.96 |
(1)根据上述数据,可计算出该盐酸的浓度约为_______________(保留四位有效数字)。
(2)在上述实验中,下列操作(其他操作正确)会造成测定结果偏高的有_______。
A.用酸式滴定管取20.00 mL待测盐酸,使用前,水洗后未用待测盐酸润洗
B.锥形瓶水洗后未干燥
C.称量NaOH固体时,有小部分NaOH潮解
D.滴定终点读数时俯视
E.碱式滴定管尖嘴部分有气泡,滴定后消失
(3)氧化还原滴定实验同中和滴定类似,指的是用已知浓度的氧化剂(还原剂)溶液滴定未知浓度的还原剂(氧化剂)溶液。现有0.001 mol·L-1KMnO4酸性溶液和未知浓度的无色H2C2O4溶液。反应离子方程式是_________________________________,滴定达到终点的标志是___________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硒(Se)和铜(Cu)在生产生活中有广泛的应用。硒可以用作光敏材料、电解锰行业的催化剂,也是动物体必需的营养元素和对植物有益的营养元素等。氯化亚铜(CuCl)广泛应用于化工、印染、电镀等行业。CuCl难溶于醇和水,可溶于氯离子浓度较大的体系,在潮湿空气中易水解氧化。以海绵铜(主要成分是Cu和少量CuO)为原料,采用硝酸铵氧化分解技术生产CuCl的工艺过程如下所示:
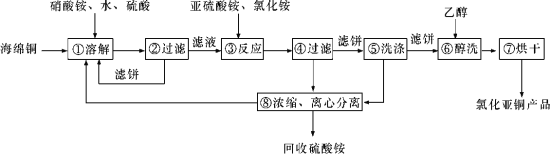
请回答下列问题:
(1)若步骤①中得到的氧化产物只有一种,则它的化学式是____________。
(2)写出步骤③中主要反应的离子方程式:_________。
(3)步骤⑤包括用pH=2的溶液酸洗、水洗两步操作,酸洗采用的酸是_______(写酸的名称)。
(4)上述工艺中,步骤⑥和⑦的作用是__________。
(5)Se为ⅥA族元素,用乙二胺四乙酸铜阴离子水溶液和硒代硫酸钠(Na2SeSO3)溶液反应可获得纳米硒化铜,硒代硫酸钠还可用于Se的精制,写出硒代硫酸钠(Na2SeSO3)与H2SO4溶液反应得到精硒的化学方程式:______________。
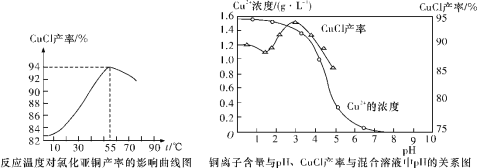
(6)氯化亚铜产率与温度、溶液pH关系如下图所示。据图分析,流程化生产氯化亚铜的过程中,温度过低影响CuCl产率的原因是_________;温度过高、pH过大也会影响CuCl产率的原因是____________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com