
����Ŀ������β���к���CO��NO2���ж����壬��������װβ������װ�ã���ʹ�ж��������Ӧת��Ϊ�����塣
��1����֪��4CO(g)��2NO2(g) ![]() 4CO2(g)��N2(g)����H����1 200 kJ��mol��1
4CO2(g)��N2(g)����H����1 200 kJ��mol��1
���ڸ÷�Ӧ���¶Ȳ�ͬ(T2>T1)������������ͬʱ������ͼ����ȷ����________(�����)��


��2������β����CO��H2O(g)��һ�������¿��Է�����Ӧ��CO(g)��H2O(g) ![]() CO2(g)��H2(g)����H��0��820 ��ʱ�ڼס��ҡ������������ܱ������У���ʼʱ�����±�����Ͷ�ϣ��ﵽƽ��״̬��K��1.0��
CO2(g)��H2(g)����H��0��820 ��ʱ�ڼס��ҡ������������ܱ������У���ʼʱ�����±�����Ͷ�ϣ��ﵽƽ��״̬��K��1.0��
��ʼ���ʵ��� | �� | �� | �� |
n(H2O)/mol | 0.10 | 0.20 | 0.20 |
n(CO)/mol | 0.10 | 0.10 | 0.20 |
��ƽ��ʱ����������CO��ת������____________���Ƚ�����������CO��ת���ʣ���________�ף���________��(����>��������������<��)��
�ڱ������У�ͨ���ı��¶ȣ�ʹCO��ƽ��ת�����������¶�____________(��������������������)��ƽ�ⳣ��K__________(����������������С������������)��
���𰸡� �� 50% �� = ���� ����
����������1���ף������¶ȣ���ѧƽ�������ƶ�����ѧ��Ӧ���ʻ�Ѹ�������뿪ԭ�������ʵ㣬�ʼ״����ң������¶ȣ���ѧ��Ӧ���ʻ�Ѹ����������T2ʱ�ȴﵽ��ѧƽ��״̬�����һ�ѧƽ�������ƶ�������������ת���ʼ�С��������ȷ���������ڷ�Ӧ��4CO��g��+2NO2��g��4CO2��g��+N2��g����T���䣬����ѹǿ��ƽ�������ƶ���һ����̼������������С���ʱ����ʴ� Ϊ�ҡ�
��2�������������CO���ĵ����ʵ���Ϊx��
CO��g��+H2O��g��![]() CO2��g��+H2��g��
CO2��g��+H2��g��
��ʼ����0.1 0.1 0 0
�仯����x x x x
ƽ������0.1-x0.1-x x x
��K=![]() =1��
=1��
���x=0.5�����Լ�������CO��ת����=![]() ��100%=50%��
��100%=50%��
����Ͷ�����֪�������൱���ڼĻ�����������ˮ������Ͷ�ϣ����Ի�ʹ��һ����̼��ת��������װ��Ͷ���Ǽ�װ�õ�2�������ڻ�ѧ��Ӧǰ��ϵ���Ͳ���ķ�Ӧ��˵��������ƽ���ǵ�Ч�ģ�������������£�ת��������ȵģ�
���������У�ͨ���ı��¶ȣ�ʹCO��ƽ��ת����������Ҫʹ��ѧƽ�����������ƶ������ڸ÷�ӦΪ���ȷ�Ӧ��Ҫ����һ����̼��ת���ʣ�Ӧ�ý����¶ȣ�����ƽ�����������ƶ�����Ӧ��Ũ�ȼ�С��������Ũ��������÷�Ӧ�Ļ�ѧƽ�ⳣ������


 ��������һ���þ�ϵ�д�
��������һ���þ�ϵ�д� Сѧ��10����Ӧ����ϵ�д�
Сѧ��10����Ӧ����ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����������ƣ�Na2S2O3)�����������ƺ����ͨ�����Ϸ�Ӧ�Ƶã�Na2SO3 + S ![]() Na2S2O3����������Һ����������ΪNa2S2O35H2O��Na2S2O3��5H2O��40��45���ۻ���48��ֽ⣻Na2S2O3������ˮ���������Ҵ�����ˮ���й����ʵ��ܽ����������ͼ��ʾ��
Na2S2O3����������Һ����������ΪNa2S2O35H2O��Na2S2O3��5H2O��40��45���ۻ���48��ֽ⣻Na2S2O3������ˮ���������Ҵ�����ˮ���й����ʵ��ܽ����������ͼ��ʾ��
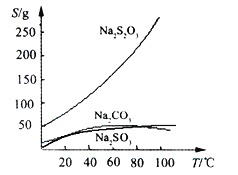

���ְ����·����Ʊ�Na2S2O35H2O��
�����ƺ�̼���ư���ӦҪ�����һ������������ƿ�У�ע��150mL����ˮʹ���ܽ⣬�ڷ�Һ©���У�ע��Ũ���ᣬ��װ��2�м����������ƹ��壬������ͼ��װ��װ�á�
��1������2������Ϊ_________________��װ��6�пɷ���_____________________(����ĸ)��
A.BaCl2��Һ B.ŨH2SO4 C.����KMnO4��Һ D.NaOH��Һ
��2����Һ©��������ע��Ũ����ʹ��Ӧ�����Ķ�����������Ͼ��ȵ�ͨ��Na2S��Na2CO3�Ļ����Һ�У����ô������������������ȣ���Ӧԭ��Ϊ��
��Na2CO3+SO2 =Na2SO3+CO2 ��Na2S+SO2+H2O=Na2SO3+H2S
��2H2S+SO2=3S��+2H2O ��Na2SO3+S![]() Na2S2O3
Na2S2O3
�ܷ�ӦΪ��2Na2S+Na2CO3+4SO2= 3Na2S2O3+CO2
���Ŷ������������ͨ�룬������Һ���д���dz��ɫ��������������ͨ�����������壬��ӦԼ��Сʱ������Һ��pH�ӽ���С��7ʱ������ֹͣͨ���ͼ��ȡ���ҺpHҪ���Ʋ�С��7������____________________________________�������ӷ���ʽ��ʾ����
����Na2S2O35H2O���궨��Һ��Ũ�ȣ�

��3��Ϊ���ٲ�Ʒ����ʧ��������Ϊ__________���������dz���ϴ�Ӹ������ϴ�Ӳ�������_______�����Լ�����ϴ�Ӽ���
��4������Ũ����Һֱ����Һ����ɫ����Ϊֹ������ʱΪʲôҪ�����¶Ȳ��˹���______________________________��
��5����ȡһ�������IJ�Ʒ���Ƴ������������Һ�����ü�ӵ������궨����Һ��Ũ�ȣ��÷�����ƽȷ��ȡ������K2Cr2O7��Ħ������294g/mol��0.5880�ˡ�ƽ���ֳ�3�ݷֱ����3����ƿ�У���ˮ�����Һ�������������KI���ữ���������з�Ӧ��6I-+Cr2O72-+14H+=3I2+2Cr3++7H2O���ټ��뼸�ε�����Һ������������Na2S2O3��Һ�ζ���������Ӧ��I2+2S2O32-=2I-+S4O62-�� ��������Na2S2O3��Һ��ƽ�����Ϊ20.00mL�������궨�����������Һ��Ũ��Ϊ_______mol/L��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����1����ʵ֤��������Ƴ�ԭ��صķ�Ӧͨ���Ƿ��ȷ�Ӧ�����л�ѧ��Ӧ�������Ͽ�����Ƴ�ԭ��ص���________(����ĸ)��
A��C(s)��H2O(g)===CO(g)��H2(g)�� ��H > 0
B��2H2(g)��O2(g)===2H2O(l)�� ��H < 0
C��NaOH(aq)��HCl(aq)===NaCl(aq)��H2O(l)����H < 0
��2������������ȼ�ϵ�صĹ���ԭ����ͼ��ʾ����֪����е����Ϊ���ڹ��������O2�����������������ƶ���
��������________ (�����缫a�������缫b��)�� O2������________��(����������������)��

�ڵ�ȼ����ΪC2H4ʱ����������������Ӧʽ�ֱ�Ϊ
������______________________��������____________________��
��3����ⷨ�������״���ˮ����ɵ���Ⱦ��ԭ���ǣ�ͨ�罫Co2��������Co3����Ȼ��Co3�����״�������CO2��H��(��ʯīϩ������ȥCo2��)��������ͼ��ʾװ��ģ���������̣����ȥ�״������ӷ���ʽΪ____________________��

�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���绯ѧ�ڻ�ѧ��ҵ���Ź㷺��Ӧ�ã�
��1����ҵұ�����Ļ�ѧ����ʽ��___________________________��
��2����ҵ���������ص���Һ�к���ijЩ����������ʣ��������ӽ�����Ĥ������ᴿ��������װ�������ӽ���Ĥ��ֻ����������ͨ�������乤��ԭ����ͼ��ʾ��
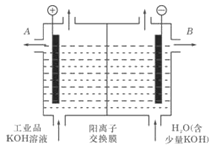
�ٸõ��۵�������Ӧʽ��________________________��
�ڳ�ȥ���ʺ������������Һ��Һ�����__________����д��A����B����������
��3���״�ȼ�ϵ��������ṹ������ת���ʸߡ��Ի�������Ⱦ������Ϊ������Դ�����Ʒ��Խ��Խ�ܵ���ע���乤��ԭ������ͼ�����ӽ���Ĥ�����������Һ��Ϊ1L 1.5 mol/L H2SO4 ��Һ��
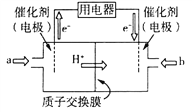
��ͨ������a�ĵ缫�ǵ�ص�________�������������������缫��ӦʽΪ___________________________________��
�ڵ��������2 mol e������ת��ʱ������������Һ��������ֵΪ_________g��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��������ʵ������Ԫ�������ɽ��͵���
A. Mg��Al��ͬŨ�����ᷴӦ��Mg������ B. ��Na2SO3��Һ�м����ᣬ�����ݲ���
C. 0.1 mol��L-1 ��Һ�ļ��ԣ�MaOH>LiOH D. ��̬�⻯����ȶ��ԣ�HBr>HI
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��������һ�ֻ���ɫ���壮1974�꣬��仯ѧ�����շ������̿���Ҫ�ɷ���MnO2����Ũ�����ϼ�������ȡ������MnO2+4HCl��Ũ�� ![]() MnCl2+Cl2��+2H2O��ͨ��Ҳ���ø�����غ�Ũ����������ȡ������2KMnO4+16HCl��Ũ���T2MnCl2+5Cl2��+2KCl+8H2O��
MnCl2+Cl2��+2H2O��ͨ��Ҳ���ø�����غ�Ũ����������ȡ������2KMnO4+16HCl��Ũ���T2MnCl2+5Cl2��+2KCl+8H2O��
��1�����������ַ�������������Ƚϣ����ǵķ���װ��ʹ�õIJ�ͬ������ ��
��2���ֽ�29g����Ϊ60%�����̿���Ҫ�ɷ�MnO2����������Ũ�����ַ�Ӧ�����ʲ��μӷ�Ӧ�����ѷ�Ӧ��������Һϡ�͵�200mL�����㣺
�����ɵ�Cl2�ڱ�״���µ������
��ϡ�ͺ���Һ��MnCl2�����ʵ���Ũ�ȣ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����59.2g Fe2O3��FeO�Ļ�����м���ijŨ�ȵ�ϡ����1.0L������������ȫ��Ӧ������NO��Fe��NO3��3����������Һ�м���1.0mol/L��NaOH��Һ2.8L����ʱ��Һ��������������������ȫ��������������Ϊ85.6g�������й�˵��������� �� ��
A. Fe2O3��FeO�����ʵ���֮��Ϊ1��6
B. ��������ʵ���Ũ��Ϊ3.0mol/L
C. ������NO�ڱ�״���µ����Ϊ4.48L
D. Fe2O3��FeO�����ᷴӦ��ʣ��0.2molHNO3
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��������ѧϰ���о���ѧ��һ�ֵ���Ҫ���������з������������ ��
A. KOH��Na2CO3�����ڼ� B. H2SO4��HNO3��������
C. K2CO3��K2O�������� D. Na2O��Na2SiO3������������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������й�˵���в���ȷ����
A. ij�ض�ʱ�Ļ����Һ��C(H+) =![]() mol��L-1��˵������Һ������(KWΪ���¶�ʱˮ�����ӻ�������
mol��L-1��˵������Һ������(KWΪ���¶�ʱˮ�����ӻ�������
B. �����£���ˮ�������c(H+)=10-12mol��L-1����Һ��PH����Ϊ2��12
C. ��֪Ksp(AgCl)=1.56��10-10��Ksp(Ag2CrO4)=9.0��10-12������Cl-��CrO42-��Ũ�Ⱦ�Ϊ0.010mol��L-1��Һ����μ���0.010mol��L-1��AgNO3��Һʱ��Cl-�Ȳ�������
D. ������PH=7��CH3COOH��CH3COONa�����Һ�У�c(Na+)=c(CH3COO-)+c(CH3COOH)
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com