
锗(Ge)是第四周期第 ⅣA 族元素,处于周期表中金属区与非金属区的交界线上,下列叙述正确的是
A.锗是一种金属性很强的元素
B.锗的单质具有半导体的性能
C.锗化氢(GeH4)稳定性很强
D.锗酸(H4GeO4)是难溶于水的强酸
 每日10分钟口算心算速算天天练系列答案
每日10分钟口算心算速算天天练系列答案科目:高中化学 来源:2013-2014天津市高三毕业班联考二理综化学试卷(解析版) 题型:选择题
下列叙述错误的是
A.化学反应能够制造出新的物质,但不能制造出新的元素
B.用Na2S作沉淀剂,可除去废水中的Cu2+和Hg2+
C.玻璃钢是一种合金,广泛用于汽车车身
D.只要符合限量,“食用色素”、“苯甲酸钠”、“亚硝酸盐”可以作为某些食品的添加剂
查看答案和解析>>
科目:高中化学 来源:2013-2014天津五区县高二下学期期末考试化学试卷(解析版) 题型:选择题
下列过程中,不涉及化学变化的是
A.甘油加水作护肤剂
B.用脂肪和烧碱加热制取肥皂
C.烹调鱼时加入少量料酒和食醋可以减少腥味、增加香味
D.在燃料煤中添加氧化钙以减少二氧化硫的生成
查看答案和解析>>
科目:高中化学 来源:2013-2014天津五区县高一下学期期末考试化学试卷(解析版) 题型:选择题
下列说法错误的是
A.含有共价键的化合物一定是共价化合物
B.在共价化合物中一定含有共价键
C.含有离子键的化合物一定是离子化合物
D.双原子单质分子中的共价键一定是非极性键
查看答案和解析>>
科目:高中化学 来源:2013-2014天津五区县高一下学期期末考试化学试卷(解析版) 题型:选择题
下列措施对增大化学反应速率明显有效的是
A.Na与水反应时增大水的用量
B.Fe与稀硫酸反应制取氢气时,改用浓硫酸
C.在K2SO4与BaCl2两溶液反应时,增大压强
D.将铝片改为铝粉,做铝与氧气反应的实验
查看答案和解析>>
科目:高中化学 来源:2013-2014四川绵阳中学实验学校高考冲刺理综化学试卷(解析版) 题型:填空题
(14分)酸性KMnO4溶液能与草酸(H2C2O4)溶液反应。某探究小组利用反应过程中溶液紫色消失快慢的方法来研究影响反应速率的因素。
Ⅰ.实验前首先用浓度为0.1000mol?L-1酸性KMnO4标准溶液滴定未知浓度的草酸。
(1)写出滴定过程中发生反应的化学方程式为 。
(2)滴定过程中操作滴定管的图示正确的是 。
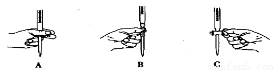
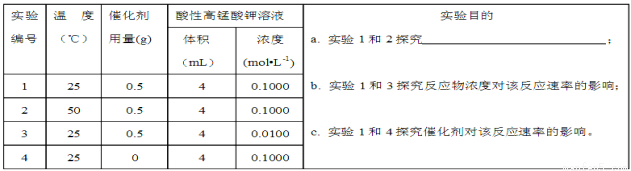
(3)若滴定前滴定管尖嘴处有气泡,滴定后消失,会使测得的草酸溶液浓度 (填“偏高”、“偏低”、或“不变”)。
Ⅱ.通过滴定实验得到草酸溶液的浓度为0.2000mol·L-1 。用该草酸溶液按下表进行后续实验(每次实验草酸溶液的用量均为8mL)。
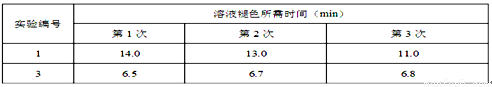
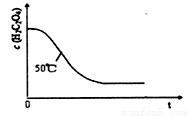
(4)写出表中a 对应的实验目的 ;若50°C时,草酸浓度c(H2C2O4)随反应时间t的变化曲线 如下图所示,保持其他条件不变,请在图中画出25°C时c(H2C2O4)随t的变化曲线示意图。
(5)该小组同学对实验1和3分别进行了三次实验,测得以下实验数据(从混合振荡均匀开始计时):
分析上述数据后得出“当其它条件相同时,酸性高锰酸钾溶液的浓度越小,褪色时间就越短,即反应速率就越快”的结论。甲同学认为该小组“探究反应物浓度对速率影响”的实验方案设计中存在问题,从而得到了错误的实验结论,请简述甲同学改进的实验方案 ______________________。
(6)该实验中使用的催化剂应选择MnSO4并非MnCl2,原因可用离子方程式表示为 。
查看答案和解析>>
科目:高中化学 来源:2013-2014四川绵阳中学实验学校高考冲刺理综化学试卷(解析版) 题型:选择题
下列离子方程式不正确的是 ( )
A.向NH4Al(SO4)2溶液中滴入Ba(OH)2恰好使SO42-反应完全:
NH4++2Ba2++4OH-+Al3++2SO42- = 2BaSO4↓+Al(OH)3↓+ NH3.H2O
B.误将洁厕灵和“84”消毒液混合:2H++Cl-+ClO-=Cl2↑+H2O
C.向明矾溶液中加入少量的Ba(OH)2溶液:
2Al3++3SO42-+3Ba2++6OH- = 3BaSO4↓+2Al(OH)3↓
D.在复盐NH4Fe(SO4)2溶液中逐滴加入Ba(OH)2溶液,可能发生的离子方程式是:
3NH4++Fe3++3SO42-+3Ba2++6OH- = 3BaSO4↓+Fe(OH)3↓+3NH3.H2O
查看答案和解析>>
科目:高中化学 来源:2013-2014四川省下学期期中考试高二化学试卷(解析版) 题型:填空题
(12分)Ⅰ.(1)AgNO3的水溶液呈 (填“酸”、“中”、“碱”)性,常温时的pH 7(填“>”、“=”、“<”),原因是(用离子方程式表示): ;实验室在配制AgNO3的溶液时,常将AgNO3固体先溶于较浓的硝酸中,然后再用蒸馏水稀释到所需的浓度,以 ________(填“促进”、“抑制”)其水解。
(2)在配制硫化钠溶液时,为了防止发生水解,可以加入少量的 。
Ⅱ. 已知水在25 ℃(A)和T ℃(B)时,其电离平衡曲线如图所示:
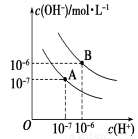
(1)25 ℃时,将pH=3 的H2SO4溶液与pH=10的NaOH溶液混合,若所得混合溶液的pH=7,则H2SO4溶液与NaOH溶液的体积比为 。
(2)T ℃时,若10体积pH1=a的某强酸溶液与1体积pH2=b的某强碱溶液混合后溶液呈中性,则混合前,该强酸的pH1与强Ⅰ碱的pH2之间应满足的关系是 。
(3)曲线B对应温度下,pH=3的HCl溶液和pH=9的某碱溶液等体积混合后,混合溶液的pH>7。请分析其原因: 。
查看答案和解析>>
科目:高中化学 来源:2013-2014四川省下学期期中考试高一化学试卷(解析版) 题型:选择题
有A、B、C、D四种金属,将A与B用导线连接起来,浸入电解质溶液,B不易腐蚀。将A、D在稀盐酸中构成原电池,电流由A通过导线流向D。将铜浸入B的盐溶液中,无明显变化。如果把铜浸入C的盐溶液中,有金属C析出。这四种金属的活动性由强到弱的顺序是( )
A.DCAB B.DABC C.DBAC D.BADC
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com