
【题目】环之间共用一个碳原子的化合物称为螺环化合物,螺[2,2]戊烷(![]() )是最简单的一种。下列关于该化合物的说法不正确的是( )
)是最简单的一种。下列关于该化合物的说法不正确的是( )
A.与环戊烯互为同分异构体
B.二氯代物超过两种
C.所有碳原子均处同一平面
D.1mol螺[2,2]戊烷充分燃烧需要7molO2
 寒假天地重庆出版社系列答案
寒假天地重庆出版社系列答案科目:高中化学 来源: 题型:
【题目】某A在一定温度下有分解反应A(s) =B(s) + C(g) + 4D(g) 若测得生成的气体的质量是同温同压下相同体积氢气质量的10倍,且当所成气体在标准状况下的体积为22.4L时,所得B的质量为30.4g则A的摩尔质量是( )
A.130.4B.50.4C.182.4D.252
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)已知由金属钠制得氧化钠,可用多种方法:a.4Na+O2===2Na2O,b.4Na+CO2===2Na2O+C,c.2NaNO2+6Na===4Na2O+N2↑。
①在上述三种方法中,最好的方法是________(填序号),原因是________________。
②上述反应c中NaNO2作________剂,当有1 mol NaNO2反应时,电子转移的数目是________________________________________________________________________。
(2)现用金属钠和空气制备纯度较高的Na2O2,可利用的装置如下。回答下列问题(注:Na2O2可以与H2O、CO2反应):
①装置Ⅳ中盛放的药品是________,其作用是____________________________。


②若规定气体的气流方向从左到右,则组合实验装置时各仪器接口的标号字母(a、b……)顺序:空气进入________,________接________,________接________,________接________。
③装置Ⅱ的作用____________________________________________________。
④操作中通空气和加热的顺序为________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】黄酮类化合物具有抗肿瘤活性,6-羟基黄酮衍生物的合成路线如下:
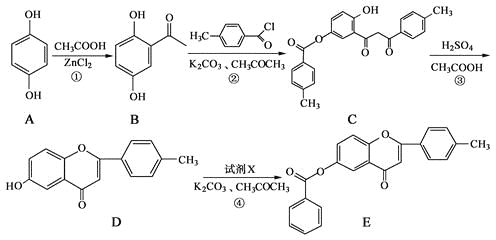
请回答下列问题:
(1)化合物B中的含氧官能团为_____和_____(填名称)。
(2)反应③中涉及到的反应类型有水解反应、_______和_______。
(3)反应④中加入的试剂X的分子式为C7H5OCl,X的结构简式为_______。
(4)B的一种同分异构体满足下列条件:
Ⅰ.能发生银镜反应,其水解产物之一能与FeCl3溶液发生显色反应。
Ⅱ.分子中有4种不同化学环境的氢。
写出该同分异构体的结构简式:___。
(5)已知: 。
。
根据已有知识并结合相关信息,写出以![]() 和CH3COOH为原料制备
和CH3COOH为原料制备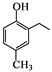 的合成路线流程图___(无机试剂任选)。合成路线流程图示例如下:
的合成路线流程图___(无机试剂任选)。合成路线流程图示例如下:
H2C=CH2![]() CH3CH2Br
CH3CH2Br![]() CH3CH2OH
CH3CH2OH
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】过氧硫酸氢钾复合盐(K2SO4KHSO42KHSO5)易分解,可用作漂白剂、NOx和SO2等的脱除剂。某研究小组制备过氧硫酸氢钾复合盐的流程如图所示。

已知:浓硫酸与H2O2反应,部分转化为过硫酸(化学式为H2SO5,是一种一元强酸)
(1)H2SO5中硫元素的化合价为+6价,其中过氧键的数目为________;工业上用过氧硫酸氢钾复合盐溶液脱除NO时,反应的离子方程式为___________________________。
(2)若反应物的量一定,在上述流程的“转化”步骤中需用冰水浴冷却,且缓慢加入浓硫酸,其目的是___________________________。
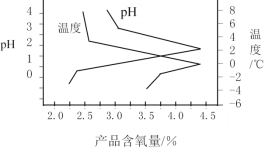
(3)“结晶”操作中,加入K2CO3即可获得过氧硫酸氢钾复合盐晶体,该过程的化学方程式为______________________________。过氧硫酸氢钾复合盐产率(以产品含氧量表示)随溶液pH和温度的变化关系如图所示,则该过程适宜的条件是_________________。
(4)产品中KHSO5含量的测定:取1.000g产品于锥形瓶中,用适量蒸馏水溶解,加入5mL5%的硫酸和5mL25%的KI溶液,再加入1mL淀粉溶液作指示剂,用0.2000mol·L-1硫代硫酸钠标准液滴定至终点,消耗标准液的体积为25.00mL。
已知:2KHSO5+4KI+H2SO4 = 2I2+3K2SO4+2H2O I2+2Na2S2O3 =Na2S4O6+2NaI
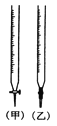
①用_____滴定管盛装标准浓度的硫代硫酸钠溶液(填“甲”或“乙”)。
②产品中KHSO5的质量分数为___________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知在柑橘、柠檬等水果中含有柠檬酸,且已知柠檬酸中只含C、H、O三种元素。取柠檬酸19.2g,在氧气中完全燃烧,产生CO2和H2O分别为26.4g和7.2g,现对该物质进行质谱分析,可获得柠檬酸的相对分子质量为192,利用红外光谱分析可知柠檬酸分子中含有﹣COOH和﹣OH。请回答:
(1)通过计算,可获得柠檬酸的分子式为_____。
(2)再利用核磁共振氢谱分析发现有4个吸收峰,其峰面积之比为4:2:1:1.综合以上信息,写出柠檬酸的结构简式_____。
(3)柠檬酸与有机物C在一定条件下发生酯化反应可生成一种相对分子质量为220的酯类物质。写出C所有可能的结构简式_____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】二苯基乙二酮常用作医药中间体及紫外线固化剂,可由二苯基羟乙酮氧化制得,反应的化学方程式及装置图(部分装置省略)如图:
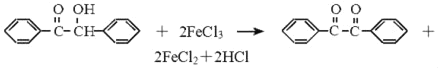
在反应装置中,加入原料及溶剂,搅拌下加热回流。反应结束后加热煮沸,冷却后即有二苯基乙二酮粗产品析出,用70%乙醇水溶 液重结晶提纯。重结晶过程:
加热溶解→活性炭脱色→趁热过滤→冷却结晶→抽滤→洗涤→干燥
请回答下列问题:
(1)写出装置图中玻璃仪器的名称:b_____。
(2)趁热过滤后,滤液冷却结晶。一般情况下,下列哪些因素有利于得到较大的晶体:_____。
A.缓慢冷却溶液 B.溶液浓度较高 C.溶质溶解度较小 D.缓慢蒸发溶剂
如果溶液中发生过饱和现象,可采用_____等方法促进晶体析出。
(3)抽滤所用的滤纸应略_____(填“大于”或“小于”)布氏漏斗内径,将全部小孔盖住。 烧杯中的二苯基乙二酮晶体转入布氏漏斗时,杯壁上往往还粘有少量晶体,需选用液体将杯壁上的晶体冲洗下来后转入布氏漏斗,下列液体最合适的是_____。
A.无水乙醇 B.饱和NaCl溶液 C.70%乙醇水溶液 D.滤液
(4)抽滤过程中要及时观察吸滤瓶内液面高度,当快达到支管口位置时应进行的操作为_____。
(5)上述重结晶过程中的哪一步操作除去了不溶性杂质:_____。
(6)某同学采用薄层色谱(原理和操作与纸层析类同)跟踪反应进程,分别在反应开始、回流15min、30min、45min和60min时,用毛细管取样、点样、薄层色谱展开后的斑点如图所示。该实验条件下比较合适的回流时间是_____。
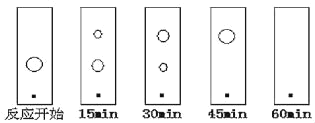
A.15min B.30min C.45min D.60min
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】新型材料 AIN 应用前景广泛,对其制备过程的研究成为热点。
(1)将物质的量均为a mol 的 Al2O3与N2 充入恒温恒容密闭容器中,控制温度发生反应:2Al2O3(s)+2N2(g) ![]() 4AlN(s) +3O2(g) △H>0。
4AlN(s) +3O2(g) △H>0。
①下列可作为反应达到平衡的判据是_________(填序号)。
A.固体的质量不再改变
B.2v正(N2)=3v逆(O 2)
C.△H 不变
D.容器内气体的压强不变
E.N2分子数与 O2 分子数比为 2:3
②在起始压强为p的反应体系中,平衡时 N2的转化率为α,则上述反应的平衡常数 Kp__________(对于气相反应,用某组分 B 的平衡压强 p(B)代替物质的量浓度c(B)也可表示平衡常数,记作Kp,如p(B) =p总·x(B) ,p总为平衡总压强,x(B)为平衡系统中B的物质的量分数)。
③为促进反应的进行,实际生产中需加入焦炭,其原因是____________。
(2)铝粉与 N2 在一定温度下可直接生成 AlN, 加入少量 NH4Cl 固体可促进反应。将等质量的A1粉与不同量的 NH4Cl混合均匀后置于充 N2的密闭容器中,电火花引燃,产品中 AlN的质量分数[ω(AlN)] 随原料中ω(NH4Cl)的变化如图1所示,燃烧过程中温度随时间变化如图2所示。则:
①固体混合物中,ω(NH4Cl)的最佳选择是__________。
②结合图2解释当ω(NH4Cl)超过一定值后,ω(AlN)明显减少的原因__________。

(3)AIN粉末会缓慢发生水解反应,粒径为100 nm 的 AlN 粉末水解时溶液 pH的变化如图3 所示。

①AlN 粉末水解的化学方程式是______________。
②相同条件下,请在图3中画出粒径为40 nm 的AlN粉末水解的变化曲线____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是( )
①由非金属元素组成的化合物一定是共价化合物 ②离子化合物一定含离子键,可能含极性键或非极性键 ③非极性键既可能存在于单质和共价化合物中,也可能存在于离子化合物中 ④所有化合物都含有化学键 ⑤元素形成化合物时,不一定都达到稀有气体元素原子的电子层结构 ⑥任何元素的原子都是由核外电子和核内中子、质子组成的⑦化学反应一定伴随着能量的变化 ⑧质子数相同的微粒一定属于同种元素
A.②③④⑤⑦B.②③⑤⑦⑧C.①③④⑥⑦D.①②④⑤⑥
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com