
两种金属的混合粉末30g,跟足量稀硫酸反应时,恰好得到22.4L氢气(标况).下列各组金属不能构成上述条件混合物的是:
A.Al和Cu B.Zn和Ag C.Mg和Al D.Al和Fe
 名题金卷系列答案
名题金卷系列答案科目:高中化学 来源: 题型:
 已知A、B、C、D、E五种元素的核电荷数依次增大,除E为第四周期元素外,其余都是短周期元素.其中A、B、C是同一周期的非金属元素,A元素最外层电子数是内层电子数的2倍,B元素基态原子的最外层有3个未成对电子,化合物DC的晶体中,D的二价阳离子与C的阴离子具有相同的电子层结构,E元素的正三价离子的3d能级为半充满状态.请根据上述情况,回答下列问题(答题时,A、B、C、D、E用所对应的元素符号表示):
已知A、B、C、D、E五种元素的核电荷数依次增大,除E为第四周期元素外,其余都是短周期元素.其中A、B、C是同一周期的非金属元素,A元素最外层电子数是内层电子数的2倍,B元素基态原子的最外层有3个未成对电子,化合物DC的晶体中,D的二价阳离子与C的阴离子具有相同的电子层结构,E元素的正三价离子的3d能级为半充满状态.请根据上述情况,回答下列问题(答题时,A、B、C、D、E用所对应的元素符号表示):m-
| ||
| m |
m-
| ||
| m |
| 2M |
| (a)3NA |
| 2M |
| (a)3NA |
查看答案和解析>>
科目:高中化学 来源: 题型:
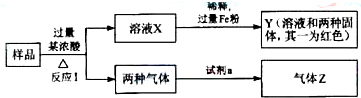
查看答案和解析>>
科目:高中化学 来源:2011-2012学年四川省成都七中高一下学期期末考试化学试卷(带解析) 题型:填空题
(14分)镁、铝是两种重要的金属,它们的单质及化合物有着各自的性质。
Ⅰ.海水中含有氯化镁,是镁的重要来源之一。从海水中制取镁,某同学设计了如下
流程步骤:
主要的步骤总结如下:①把贝壳制成石灰乳 ②往母液中加石灰乳,沉降、过滤,得到Mg(OH)2沉淀 ③将沉淀物与盐酸反应,结晶、过滤,将制得的晶体脱水得无水MgCl2
④将得到的产物熔融后电解。
(1)下列说法不正确的是__________________(填代号)
| A.此法的优点之一是原料来源丰富 |
| B.进行①②③步骤的目的是从海水中提取氯化镁 |
| C.第④步电解法制取镁是由于镁是很活泼的金属 |
| D.以上制取镁的过程中涉及的反应有分解反应、化合反应和置换反应 |
查看答案和解析>>
科目:高中化学 来源:2014届四川省高一下学期期末考试化学试卷(解析版) 题型:填空题
(14分)镁、铝是两种重要的金属,它们的单质及化合物有着各自的性质。
Ⅰ.海水中含有氯化镁,是镁的重要来源之一。从海水中制取镁,某同学设计了如下
流程步骤:

主要的步骤总结如下:①把贝壳制成石灰乳 ②往母液中加石灰乳,沉降、过滤,得到Mg(OH)2沉淀 ③将沉淀物与盐酸反应,结晶、过滤,将制得的晶体脱水得无水MgCl2
④将得到的产物熔融后电解。
(1)下列说法不正确的是__________________(填代号)
A.此法的优点之一是原料来源丰富
B.进行①②③步骤的目的是从海水中提取氯化镁
C.第④步电解法制取镁是由于镁是很活泼的金属
D.以上制取镁的过程中涉及的反应有分解反应、化合反应和置换反应
(2)步骤②不够合理,理由是
Ⅱ.(1)铝、空气、海水可组成一种电池,广泛用于制造航标灯。此电池正极的电极反应为 。
(2)铝热还原法是冶炼熔点较高的金属的一种重要方法,焊接钢轨即用到此法。将干燥的氧化铁粉末和铝粉均匀混合后放入纸漏斗中(漏斗已事先处理好),并架在铁架台上,
下面放置一个盛有沙子的蒸发皿。请写出引发铝热反应的操作及该反应的化学方程式:
操作
化学方程式 。
(3)为确定某铝热剂(氧化铁粉末和铝粉)的组成,分别进行下列实验。
若取10.7 g样品,向其中加入足量的NaOH溶液,测得生成的气体(标准状况)体积为3.36 L ,反应的化学方程式为 ,样品中铝的质量是 g。
若取10.7 g样品将其点燃,恰好完全反应,待反应产物冷却后,加入足量盐酸,测得生成的气体体积为a L,该气体与上小题中所得气体的体积比等于 ∶ 。
查看答案和解析>>
科目:高中化学 来源:枣庄模拟 题型:问答题
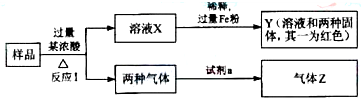
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com