
| A. | 未加醋酸时:c(OH-)=c(Na+) | |
| B. | 加入10mL醋酸时:c(OH-)>c(Na+)>c(CH3COO-)>c(H+) | |
| C. | 加入醋酸至溶液pH=7时:c(CH3COO-)=c(Na+) | |
| D. | 加入20mL醋酸时:2c(OH-)=c(CH3COO-)+2c(H+) |
分析 A.未滴加醋酸时为氢氧化钠溶液,根据氢氧化钠溶液中的电荷守恒判断;
B.此时溶质为等浓度的氢氧化钠和醋酸钠,溶液呈碱性,且钠离子浓度最大;
C.溶液为中性时,c(OH-)=c(H+),结合电荷守恒判断;
D.加入20mL醋酸时,反应后溶质为醋酸钠,溶液中氢氧根离子浓度远远小于醋酸根离子浓度.
解答 解:A.氢氧化钠溶液中,根据电荷守恒可得:c(OH-)=c(H+)+c(Na+),则c(OH-)>c(Na+),故A错误;
B.加入10mL醋酸时,溶质为等浓度的氢氧化钠和醋酸钠,溶液呈碱性,且钠离子浓度最大,则正确的离子浓度大小为:c(Na+)>c(OH-)>c(CH3COO-)>c(H+),故B错误;
C.加入醋酸至溶液pH=7时:c(OH-)=c(H+),根据电荷守恒可得:c(CH3COO-)=c(Na+),故C正确;
D.加入20mL醋酸时,溶质为醋酸钠,醋酸根离子的水解程度较小,则:c(OH-)<<c(CH3COO-),溶液中离子浓度关系为:2c(OH-)<c(CH3COO-)+2c(H+),故D错误;
故选C.
点评 本题考查了离子浓度大小比较,题目难度中等,明确反应后溶质组成为解答关键,注意掌握盐的水解原理、电荷守恒、物料守恒等知识在判断离子浓度大小中的应用方法.


 学练快车道快乐假期寒假作业系列答案
学练快车道快乐假期寒假作业系列答案科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | H2O的摩尔质量是18g | |
| B. | 一个12C的实际质量约等于$\frac{12}{6.02×1{0}^{23}}$g | |
| C. | 任何物质的摩尔质量都等于它的式量 | |
| D. | SO2的摩尔质量是64g/mol |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1mol O的质量为16g•mol-1 | |
| B. | 1mol He约含有6.02×1023个原子 | |
| C. | 2H既表示2个氢原子,又表示2mol氢原子 | |
| D. | 1mol HCl约含有6.02×1023个原子 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
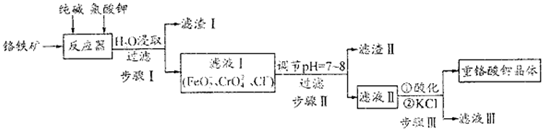
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
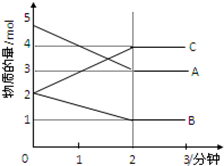 某可逆反应在某体积为5L的密闭容器中进行,在从0~3分钟各物质的量的变化情况如图所示(A,B,C均为气体)
某可逆反应在某体积为5L的密闭容器中进行,在从0~3分钟各物质的量的变化情况如图所示(A,B,C均为气体)查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com