
【题目】下列叙述正确的是( )
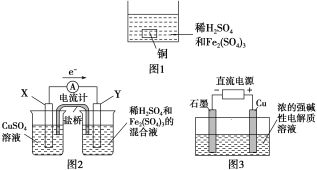
A. 如图1所示将一定量的铜片加入到100 mL稀硫酸和硫酸铁的混合溶液中,若铜片完全溶解时(不考虑盐的水解及溶液体积的变化),溶液中的Fe3+、Cu2+、H+三种离子的物质的量浓度相等,且测得溶液的pH=1,则溶液中c(SO![]() )为0.5 mol/L
)为0.5 mol/L
B. 如图2所示的装置中发生Cu+2Fe3+===Cu2++2Fe2+的反应,X极是负极,Y极的材料可以是铜
C. Cu2O是一种半导体材料,基于绿色化学理念设计的制取Cu2O的电解池示意图如图3所示,石墨电极上产生氢气,铜电极发生还原反应
D. 如图3所示当有0.1 mol电子转移时,有0.1 mol Cu2O生成
【答案】A
【解析】
A.根据溶液中离子间存在电荷守恒原则计算;B.由电子转移方向可以知道X为负极,Y为正极,负极应为Cu;C.Cu被氧化生成Cu2O,应为电解池的阳极反应;D.根据电极方程式2Cu-2e-+2OH-=Cu2O+H2O 进行计算。
A.pH=1,则c(H+)=0.1 mol/L,由电荷守恒可以知道3c(Fe3+)+2c(Cu2+)+c(H+)+3c(Fe2+)=2c(SO![]() ),且溶液中的Fe3+、Cu2+、H+三种离子的物质的量浓度相等,由Cu+2Fe3+===Cu2++2Fe2+可以知道, c(Fe2+)= 0.2 mol/L ,可计算得出c(SO
),且溶液中的Fe3+、Cu2+、H+三种离子的物质的量浓度相等,由Cu+2Fe3+===Cu2++2Fe2+可以知道, c(Fe2+)= 0.2 mol/L ,可计算得出c(SO![]() )=0.5 mol/L ,A项正确;B.由电子转移方向可以知道X为负极,Y为正极,负极应为Cu,Y极的材料可以活泼性比铜弱的金属或非金属,故B错误;C.Cu被氧化生成Cu2O,应为电解池的阳极反应,发生氧化反应,故C错误;D.电极方程式为2Cu-2e-+2OH-=Cu2O+H2O,当有0.1 mol电子转移时,有0.05molCu2O生成,故D错误; 正确选项A。
)=0.5 mol/L ,A项正确;B.由电子转移方向可以知道X为负极,Y为正极,负极应为Cu,Y极的材料可以活泼性比铜弱的金属或非金属,故B错误;C.Cu被氧化生成Cu2O,应为电解池的阳极反应,发生氧化反应,故C错误;D.电极方程式为2Cu-2e-+2OH-=Cu2O+H2O,当有0.1 mol电子转移时,有0.05molCu2O生成,故D错误; 正确选项A。


科目:高中化学 来源: 题型:
【题目】不同温度下,水溶液中c(H+)与c(OH-)的关系如下图所示。下列有关说法不正确的是( )
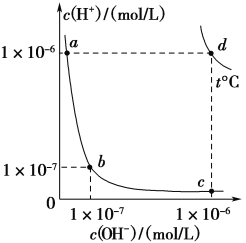
A. d点对应的食盐水pH=6,呈中性
B. 向a点对应的CH3COOH溶液中滴加NaOH溶液至b点,此时c(Na+)=c(CH3COO-)
C. 温度为t ℃时,0.05 mol/L Ba(OH)2溶液的pH=11
D. a点对应的稀硫酸与c点对应的CH3COONa溶液中水的电离程度相同
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】环境中常见的重金属污染物有汞、铅、锰、铬、镉。处理工业废水中含有的![]() 和
和![]() 常用的方法是还原沉淀法,该法的工艺流程为
常用的方法是还原沉淀法,该法的工艺流程为![]()
![]()
![]()
![]() Cr3+
Cr3+![]() Cr(OH)3。
Cr(OH)3。
其中第①步存在平衡:2![]() (黄色)+2H+
(黄色)+2H+![]()
![]() (橙色)+H2O。
(橙色)+H2O。
(1)写出第①步反应的平衡常数表达式:_________________________________。
(2)关于第①步反应,下列说法正确的是________(填序号)。
A.通过测定溶液的pH可以判断反应是否已达到平衡状态
B.该反应为氧化还原反应
C.在强酸性环境下,溶液的颜色为橙色
(3)第②步反应中,还原0.1 mol![]() ,需要________mol FeSO4·7H2O。
,需要________mol FeSO4·7H2O。
(4)第③步反应除生成Cr(OH)3沉淀外,还可能生成的沉淀为________。
(5)在溶液中存在以下沉淀溶解平衡:Cr(OH)3(s)![]() Cr3+(aq)+3OH-(aq)。常温下,Cr(OH)3的溶度积常数Ksp=10-32,当溶液中Cr3+的浓度降至10-5mol·L-1,认为Cr3+已经完全沉淀。现将第③步反应后溶液的pH调至4,请通过计算说明Cr3+是否沉淀完全(请写出计算过程)。____________
Cr3+(aq)+3OH-(aq)。常温下,Cr(OH)3的溶度积常数Ksp=10-32,当溶液中Cr3+的浓度降至10-5mol·L-1,认为Cr3+已经完全沉淀。现将第③步反应后溶液的pH调至4,请通过计算说明Cr3+是否沉淀完全(请写出计算过程)。____________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业上通过电解MnSO4和ZnSO4制取Zn和MnO2,原料为软锰矿和闪锌矿。软锰矿主要含有MnO2(约70%)、SiO2、Al2O3,闪锌矿主要含有ZnS(约80%)、FeS、CuS、SiO2。
I.(1)为了测量软锰矿中MnO2含量的测定,现将14.5g软锰矿溶于足量的稀硫酸中,加入足量的碘化钾晶体,充分反应后,过滤,将滤液加水稀释至1L,取25.00ml该溶液于锥形瓶中,滴入几滴淀粉溶液作指示剂,用0.1000mol·L﹣1的标准Na2S2O3溶液滴定,消耗标准液50.00ml,则软锰矿中MnO2含量____。(已知:2KI+2H2SO4+MnO2=I2+2H2O+MnSO4+K2SO4;I2+2S2O32﹣=2I﹣+S4O62﹣)
Ⅱ.研人员开发了综合利用这两种资源的同槽酸浸工艺,工艺流程如图所示。请回答下列问题:
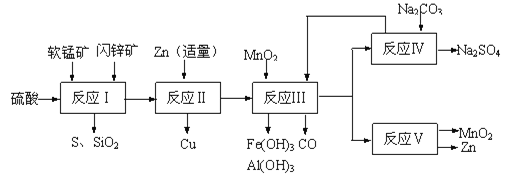
(2)反应Ⅰ后过滤所得滤液中含有有Mn2+、Zn2+、Cu2+、Fe3+、Al3+等金属阳离子。试写出反应Ⅰ中生成CuSO4的化学方程式____________。
(3)若反成Ⅱ加入的锌过量,还会进一步发生反应的离子方程式为_________。
(4)反应Ⅲ中加入MnO2的作用是(离子方程式表示)______________________。
(5)反应Ⅴ的条件是电解,电解时均用惰性电极,阳极发生的电极反应可表示为__________。
(6)图是Na2SO4和Na2SO4·10H2O的溶解度曲线(g/100g水),则Ⅳ中得到Na2SO4固体的操作是:将分离出MnCO3和ZnCO3后的滤液升温结晶→___→用乙醇洗涤→干燥.用乙醇洗涤而不用水洗的原因是___________。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定条件下,纤维素与乙酸酐反应可以制取醋酸纤维,同时还有乙酸生成,请写出化学方程式__________________________ ,化学反应类型_________________。已知某纤维乙酸酯的平均相对分子质量为311040,则对应的纤维素分子中平均含有的葡萄糖结构单元数(即聚合度n)是___________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下表是元素周期表的一部分,表中所列的字母分别代表某一元素。
B | C | D | |||||
A | E | F | |||||
(1)A的的最高价氧化物对应水化物的电子式为__________。
(2)R是由表中已标出的A~F 中某三种元素组成的化合物,是常见家用消毒剂的主要成分,其化学名称为_____________;Na2FeO4是工业常用的消毒剂,利用R 制备Na2FeO4的原理如下,请补齐缺少的物质,并配平反应方程式的系数:___ Fe(OH)3 + ___R(________) + ___ NaOH = ____ Na2FeO4 + ___ NaCl + ____H2O
(3)气态氢化物沸点:D _____ E;元素形成的简单离子的半径:A _____ D(填“>”,“<”或“=”)
(4)E 的某种氧化物通入F 单质的水溶液中,并不能增大F 单质水溶液的漂白性,请结合方程式说明______________________________________________________________。
(5)由表中未标出的某种金属元素的单质G ,可以发生如图所示的转化:
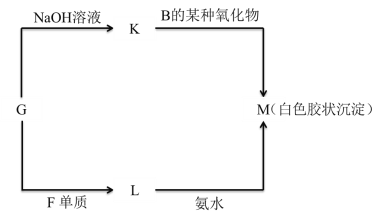
①写出 G 转化为 K 的化学方程式________________________________________。
②写出 L 转化为 M 的离子方程式________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】聚合物H ( )是一种聚酰胺纤维,广泛用于各种刹车片,其合成路线如下:
)是一种聚酰胺纤维,广泛用于各种刹车片,其合成路线如下:

已知:①C、D、G均为芳香族化合物,分子中均只含两种不同化学环境的氢原子。
②Diels-Alder反应:![]() 。
。
(1)生成A的反应类型是_______。D的名称是_______。F中所含官能团的名称是_______。
(2)B的结构简式是_______;“B→C”的反应中,除C外,另外一种产物是_______。
(3)D+G→H的化学方程式是______。
(4)Q是D的同系物,相对分子质量比D大14,则Q可能的结构有______种,其中核磁共振氢谱有4组峰,且峰面积比为1:2:2:3的结构简式为______(任写一种)。
(5)已知:乙炔与1,3-丁二烯也能发生Diels-Alder反应。请以1,3-丁二烯和乙炔为原料,选用必要的无机试剂合成 ,写出合成路线__________(用结构简式表示有机物,用箭头表示转化关系,箭头上注明试剂和反应条件)。
,写出合成路线__________(用结构简式表示有机物,用箭头表示转化关系,箭头上注明试剂和反应条件)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】以煤为原料,经过化学加工使煤转化为气体、液体、固体燃料以及各种化工产品的工业叫煤化工。
(1)将水蒸气通过红热的炭即可产生水煤气。反应为C(s)+H2O(g)![]() CO(g)+H2(g) ΔH=+131.3 kJ·mol-1。一定温度下,在一个容积可变的密闭容器中,发生上述反应,下列能判断该反应达到化学平衡状态的是________(填字母)。
CO(g)+H2(g) ΔH=+131.3 kJ·mol-1。一定温度下,在一个容积可变的密闭容器中,发生上述反应,下列能判断该反应达到化学平衡状态的是________(填字母)。
a.容器中的压强不变
b.1 mol H—H键断裂的同时,断裂2 mol H—O键
c.c(CO)=c(H2)
d.密闭容器的容积不再改变
(2)将不同量的CO(g)和H2O(g)分别通入体积为2 L的恒容密闭容器中,进行反应CO(g)+H2O(g)![]() CO2(g)+H2(g),得到如下三组数据:
CO2(g)+H2(g),得到如下三组数据:
实验组 | 温度/℃ | 起始量/mol | 平衡量/mol | 达到平衡所需时间/min | ||
H2O | CO | H2 | CO | |||
1 | 650 | 2 | 4 | 1.6 | 2.4 | 6 |
2 | 900 | 1 | 2 | 0.4 | 1.6 | 3 |
3 | 900 | a | b | c | d | t |
①实验1中从反应开始至平衡以CO2表示的平均反应速率为v(CO2)=____________(取小数点后两位,下同)。
②该反应的正反应为________(填“吸”或“放”)热反应,实验2条件下平衡常数K=________。
(3)目前工业上有一种方法是用CO2来生产甲醇。一定条件下发生反应:CO2(g)+3H2(g)![]() CH3OH(g)+H2O(g),如图表示该反应进行过程中能量(单位为kJ·mol-1)的变化。在体积为1 L的恒容密闭容器中,充入1 mol CO2和3 mol H2,达到平衡后下列措施中能使c(CH3OH)增大的是________(填字母)。
CH3OH(g)+H2O(g),如图表示该反应进行过程中能量(单位为kJ·mol-1)的变化。在体积为1 L的恒容密闭容器中,充入1 mol CO2和3 mol H2,达到平衡后下列措施中能使c(CH3OH)增大的是________(填字母)。
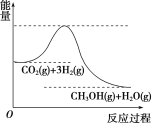
a.升高温度
b.充入He(g),使体系压强增大
c.将H2O(g)从体系中分离出来
d.再充入1 mol CO2和3 mol H2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】以红土镍矿(主要成分为NiS、FeS和SiO2等)为原料制备兰尼镍的工艺流程如下所示。
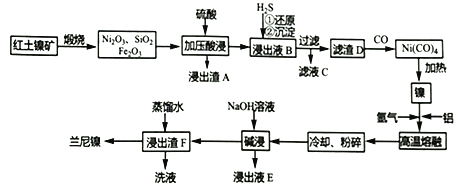
(1)形成Ni(CO)4时碳元素的化合价没有变化,则Ni(CO)4中的Ni的化合价为___________。
(2)Ni2O3有强氧化性,加压酸浸时有气体产生且镍被还原为Ni2+,则产生的气体为______(填化学式)。
(3)滤渣D为单质镍、硫的混合物,请写出向浸出液B中通入H2S气体时所有反应的离子方程式:__________________________,_________________________。
(4)已知:3Fe2++2[Fe(CN)6]3-==Fe3[Fe(CN)6]2↓(蓝色沉淀);下列可以用于检验滤液C中金属阳离子的试剂有____________(填标号)
a.KSCN溶液 b.K3[Fe(CN)6] c.K4[Fe(CN)6] d.苯酚
(5)仿照下面示例,设计从浸出液E回收氧化铝的流程:浸出液E_______________。
(示例:CuO![]() Cu2+
Cu2+![]() Cu)
Cu)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com