
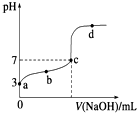
 常温下下向20mL 0.1mol?L-1 CH3COOH溶液中逐滴加入0.1mol?L-1 NaOH溶液,其pH变化曲线如图所示(忽略温度变化).下列说法中不正确的是( )
常温下下向20mL 0.1mol?L-1 CH3COOH溶液中逐滴加入0.1mol?L-1 NaOH溶液,其pH变化曲线如图所示(忽略温度变化).下列说法中不正确的是( )| A、a点表示的溶液中c(CH3COO-)等于10-3mol?L-1 |
| B、b点表示的溶液中c(CH3COO-)>c(Na+) |
| C、c点表示的溶液中c(CH3COO-)=c(Na+) |
| D、d点表示的溶液中c(Na+)>c(CH3COO->c(OH-)>c(H+) |


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
| A、嫦娥三号月球车玉兔号在进入第二个月夜休眠前,出现了机构控制异常情况,其病因或为月尘,即月球上直径小于10微米的浮尘,月尘分散在空气中形成的分散系不属于胶体 |
| B、我国航天员穿的航天服使用了高强度、高韧性的特种尼龙,它是一种高分子化合物 |
| C、有机玻璃是以M(甲基丙烯酸甲酯)为单体,通过加聚反应得到的.合成M的一种方法CH3C≡CH+CO+CH3OH→CH2=C(CH3)COOCH3符合绿色化学的要求 |
| D、我国作为燃煤大国,酸雨的危害十分严重,安装烟气脱硫设施进行脱硫,吸收塔内浆液的pH值越高,越不利于SO2的吸收 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 元素代号 | L | M | X | R | T |
| 原子半径(nm) | 0.160 | 0.143 | 0.102 | 0.089 | 0.074 |
| 主要化合价 | +2 | +3 | +6、-2 | +2 | -2 |
| A、L、T形成的简单离子核外电子数相等 |
| B、R的氧化物对应的水化物呈强碱性 |
| C、X单质在氧气中燃烧生成XO3 |
| D、离子半径大小:r(M3+)>r(T2-) |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、在食用盐中添加适量的碘酸钾 |
| B、用聚氯乙烯塑料袋包装食品 |
| C、在食品加工中科学使用食品添加剂 |
| D、研发高效低毒的农药,降低蔬菜的农药残留量 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 放电 |
| 充电 |
| A、放电时负极反应式为:NiOOH+H2O+e-═Ni(OH)2+OH- |
| B、放电过程电子从正极流向负极 |
| C、放电时溶液中正极附近OH-浓度变小 |
| D、充电时电解质溶液中的OH-向阳极移动 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、同时改变两个变量来研究反应速率的变化,能更快得出有关规律 |
| B、依据某化合物熔融状态能导电,推出此化合物中一定存在离子键 |
| C、依据丁达尔现象可将分散系分为溶液、胶体与浊液 |
| D、从HF、HCl、HBr、HI酸性递增的事实,推出F、Cl、Br、I的非金属递增的规律 |
查看答案和解析>>
科目:高中化学 来源: 题型:

| A、图1表示pH相同的盐酸和醋酸加水稀释时溶液导电能力的变化 |
| B、图1表示物质的量浓度相同的盐酸和醋酸加水稀释时溶液导电能力的变化 |
| C、图2中,t℃时饱和溶液的质量分数为m% |
| D、图2中,若保持温度不变,可以通过添加溶质的方法使溶液组成从a点变为b点 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
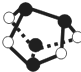 NA表示阿伏加德罗常数的值,下列说法正确的是( )
NA表示阿伏加德罗常数的值,下列说法正确的是( )| A、0.5mol雄黄(As4S4结构如图)含有NA个S-S键 | ||||
| B、7.8g Na2S和7.8g Na2O2中含有的阴离子数目均为0.1NA | ||||
C、1.8g
| ||||
| D、氧原子总数为0.2NA的SO2和O2的混合气体,其体积为2.24L |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com