
(12��)����ұ���ʹ������漰���෴Ӧ��
��1������������ұ����Ӧ����ʱ���õ�ⷨ����______
a��Fe2O3 b��NaCl c��Cu2S d��Al2O3
��2����ͭ��Cu2S���ɷ�����Ӧ2Cu2S + 2H2SO4 + 5O2 �� 4CuSO4 + 2H2O���÷�Ӧ�Ļ�ԭ����______����1molO2������Ӧʱ����ԭ����ʧ���ӵ����ʵ���Ϊ______mol��
��3��ͼΪ��⾫������ʾ��ͼ��______����a��b����Ϊ�������ʵĴ�������b������������ɫ�������ɣ������ɸ�����ĵ缫��ӦʽΪ ��
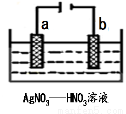
��4��Ϊ������������ĺڰߣ�Ag2S�������������������������ʳ��ˮ�в������Ӵ���Ag2Sת��ΪAg��ʳ��ˮ������Ϊ �����ܷ�ӦʽΪ�� ��
��5����¯������ұ��������Ҫ��������������Ҫ��ӦΪ��Fe2O3��s��+3CO��g��= 2Fe��s��+3CO2��g��
��֪����FeO(s) + CO(g) �� Fe(s) + CO2(g) ��H1����11KJ/mol
��3Fe2O3(s) + CO(g) �� 2Fe3O4(s) + CO2(g) ��H2����47KJ/mol
��Fe3O4(s) + CO(g) �� 3FeO(s) + CO2(g) ��H3��+19KJ/mol
��ӦFe2O3��s�� + 3CO��g��= 2Fe��s��+ 3CO2��g���ġ�H�� ��
��12�֣�
(1)b d (2��)
(2) Cu2S�� 4 (��1��)
(3)a (1��)�� NO3�� + 2H+ + e�� =NO2 ��+H2O(2��)
(4)�ٵ��磨�����������Һ������ˮ�����˻�ѧ��Ӧ(���������һ�㼴��1��)�� 3Ag2S+2Al+3H2O=2Al(OH)3+3H2S��+6Ag (2��)
(5)-25kJ/mol (2��)
��������
�����������1�����õ�ⷨ����ұ���Ľ���һ���ǽϻ��õĽ������������ڵ��Ȼ��ơ�����������ȡ�ơ�������ȡ����ͭͨ�����û�ԭ�������Դ�ѡbd��
��2��2Cu2S + 2H2SO4 + 5O2 �� 4CuSO4 + 2H2O�У���ԭ����Ԫ�ػ��ϼ����ߵ�Ԫ�أ�����CuԪ�صĻ��ϼ۴�+1�����ߵ�+2�ۣ�����Cu2S����ԭ������1molO2������Ӧʱ����ԭ��ʧȥ���ӵ����ʵ���Ҳ���������õ����ӵ����ʵ������÷�Ӧ����������������1mol������Ӧʱ�õ�4mol���ӣ����Ի�ԭ��ʧȥ���ӵ����ʵ�����4mol��
��3����⾫����ʱ���������������������������������Դ����������������aΪ������b����������ɫ���壬�����ɫ����Ϊ����������˵�����ֵ���������ӷ�����ԭ��Ӧ���ɶ����������缫��ӦʽΪNO3�� + 2H+ + e�� =NO2 ��+H2O��
��4��Ϊ������������ĺڰߣ�Ag2S�������������������������ʳ��ˮ�в������Ӵ���ʹAl��Ag2S��ʳ��ˮ����ԭ��أ���Al����صĸ�������������Ӧ����Ag2S������ԭ��Ӧ������ԭΪAg������ʳ��ˮ���������Һ��������ã�ͬʱˮҲ�����˷�Ӧ���ܷ�ӦΪAl��ˮ��Ag2S����������ԭ��Ӧ����Ag���������������⣬��ѧ����ʽΪ3Ag2S+2Al+3H2O=2Al(OH)3+3H2S��+6Ag��
��5�����ݸ�˹���ɣ������� �Ȼ�ѧ����ʽ��δ���ֵ�������ȥ����������Ȼ�ѧ����ʽΪ����+2��+6�٣�/3������Fe2O3��s�� + 3CO��g��= 2Fe��s��+ 3CO2��g���ġ�H��[����47KJ/mol��+2����+19KJ/mol��+6��(��11KJ/mol)]/3=-25kJ/mol��
���㣺����������ԭ��Ӧ�ķ��������ԭ����Ӧ�ã���˹���ɵ�Ӧ�ã�



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ��2014-2015ѧ���㽭ʡ������ѧ��10���¿���ѧ�Ծ��������棩 ���ͣ�ѡ����
����˵����ȷ����
A����֪ ����Լ���CH3��CH3 �� CH2��CH2��H2����H =��125.6 kJ/mol
����Լ���CH3��CH3 �� CH2��CH2��H2����H =��125.6 kJ/mol
B����˵��NH3���H+������H2Oǿ��NH3+H3O+=NH+4+H2O
C����֪�����Ȼ�ѧ����ʽ��2H2(g)+O2(g) === 2H2O(g) ��H����484kJ/mol����������ȼ����Ϊ��242kJ/mol
D����֪�к���Ϊ��57.4kJ/mol ����NaOH��aq�� ��CH3COOH��aq����CH3COONa��aq����H2O��l������H ����57.4kJ/mol
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2014-2015ѧ��ɽ��ʡ�����и���12��У�����ϼ�⻯ѧ�Ծ��������棩 ���ͣ�ѡ����
����Cu2O���ھ��������Ĵ����ܶ��ܵ���ע���������ӽ���Ĥ���Ƶ��Һ��OHһ��Ũ���Ʊ�����Cu2O��װ����ͼ��ʾ�������ķ�ӦΪ��2Cu+H2O Cu2O+H2��������˵����ȷ����
Cu2O+H2��������˵����ȷ����
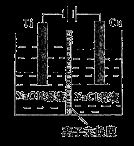
A���ѵ缫����������Ӧ
B������������Һ��pH������
C�����ӽ���ĤӦ�������������ӽ���Ĥ
D��������Ӧʽ�ǣ�2Cu+2OHһһ2eһ== Cu2O+H2O
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2014-2015ѧ��ɽ��ʡ�����и���12�¼�����ۻ�ѧ�Ծ��������棩 ���ͣ������
(19��) ��1������H2S������ȡ�����ķ����ж��֡�
�ٸ����ȷֽⷨ����֪��H2S(g)  H2(g)+1/2S2(g)��H�ں����ܱ������У����Ʋ�ͬ�¶Ƚ���H2S�ֽ�ʵ�顣��H2S��ʼŨ�Ⱦ�Ϊc mol/L�ⶨH2S��ת���ʣ������ͼ��
H2(g)+1/2S2(g)��H�ں����ܱ������У����Ʋ�ͬ�¶Ƚ���H2S�ֽ�ʵ�顣��H2S��ʼŨ�Ⱦ�Ϊc mol/L�ⶨH2S��ת���ʣ������ͼ��
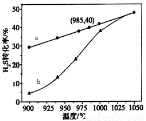
ͼ��aΪH2S��ƽ��ת�������¶ȹ�ϵ���ߣ�b���߱�ʾ��ͬ�¶��·�Ӧ������ͬʱ����δ�ﵽ��ѧƽ��ʱH2S��ת���ʡ���H_____0(���=��)��˵�����¶ȵ����ߣ�����b������a������ԭ��________________________��
�ڵ绯ѧ�����÷�������̵�ʾ��ͼ��ͼ��
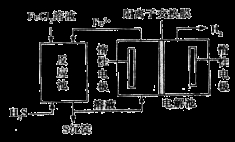
��Ӧ���з�Ӧ�����ӷ���ʽ��_____________________________��
��Ӧ�����Һ������أ�����ܷ�Ӧ�����ӷ���ʽΪ___________________________________��
��2����Al��NiO(OH)Ϊ�缫��NaOH��ҺΪ���Һ�������һ�����͵�أ��ŵ�ʱNiO(OH)ת��ΪNi(OH)2��
�ٸõ�صĸ�����Ӧʽ__________________���ڵ���ܷ�Ӧ�Ļ�ѧ����ʽ__________________��
��3��ij�������ƹ����п��ܺ���̼���ƺ��������ƣ��ֲⶨ�������Ƶĺ�����
��֪��5NaNO2+2KMnO4+3H2SO4=5NaNO3+2MnSO4+K2SO4+3H2O
��ȡ4.000g���壬����ˮ���250mL��Һ��ȡ25.00mL��Һ����ƿ��,��0.1000mol��L������KMnO4��Һ���еζ���ʵ�������������±���ʾ��
����� | 1 | 2 | 3 | 4 |
KMnO4��Һ�����/ml | 20.60 | 20.02 | 20.00 | 19.98 |
�ٵ������һ������KMnO4��Һ����Һ___________��30���ڲ��ָ������жϴﵽ�ζ��յ㡣
�ڵ�һ��ʵ�����ݳ����쳣����������쳣��ԭ�������____________(�����)��
A����ʽ�ζ���������ˮϴ����δ�ñ�Һ��ϴ��
B����ƿϴ����δ���
C���ζ��������Ӷ���
�۸��ݱ������ݣ��������ù������������Ƶ���������_____________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2014-2015ѧ��ɽ��ʡ�����и���12�¼�����ۻ�ѧ�Ծ��������棩 ���ͣ�ѡ����
�±��ж�Ӧ��ϵ�������
A | NaCl=Na++Cl-��NH3?H2O | �����ڵ��뷽��ʽ |
B | Ba2++SO42-=BaSO4��; HCO3-+OH-=CO32-+H2O | ���ɱ�ʾһ�෴Ӧ |
C | SO2ʹ���Ը��������Һ��ɫ�� SO2ʹ���Է�̪��Һ��ɫ | ������SO2��ͬһ���� |
D | Cl2��2NaOH=NaCl��NaClO��H2O�� 3S+ 6NaOH=2Na2S��Na2SO3��3H2O�� | Cl2��S�ڷ�Ӧ�м���������������ԭ�� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2014-2015ѧ�����ʡӢ��ѧУ������ѧ��12���¿���ѧ�Ծ��������棩 ���ͣ�ѡ����
a molNa2O2��b molNaHCO3�����Ϻ����ܱ������м��ȵ�250�棬ʹ���ַ�Ӧ�����ų�����Ϊ��������ʱ��a:b������Ϊ
A��3:2 B��4:5 C��2:3 D��3:4
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2014-2015ѧ�����ʡӢ��ѧУ������ѧ��12���¿���ѧ�Ծ��������棩 ���ͣ�ѡ����
������֤��Ԫ�صķǽ����Ա���Ԫ��������ʵ��
��H2Sˮ��Һ�����ᣬHClˮ��Һ��ǿ��
������������Һ�е�����ˮ�е���������
���������ֱ�������ͭ��Ӧ���������FeS��Cu2S��FeCl3��CuCl2
�ܸ����ᣨHClO4�������Ա�����ǿ
A���٢ڢ� B���ڢ� C���ڢۢ� D���٢ڢۢ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2014-2015ѧ��㶫ʡ��У���˸������������������ۺ��Ծ��������棩 ���ͣ�ѡ����
������������Һ���ܴ��������һ����
A��K����H����ClO����SO32�� B��Fe3����Mg2����NO3����CO32��
C��Na����Ca2����HCO3����OH�� D��Al3����NH4����Cl����SO42��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2014-2015ѧ��㶫ʡ��ݸ����У�߶���ѧ������������ѧ�Ծ��������棩 ���ͣ�ѡ����
�����κ�һ��ƽ����ϵ���������´�ʩ��һ����ʹƽ���ƶ�����
A������һ�ַ�Ӧ�� B�������¶�
C����ƽ����ϵ����ѹǿ D��ʹ�ô���
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com