

 +Br2
+Br2
 +HO-NO2
+HO-NO2
分析 (1)甲烷与氯气反应生成一氯甲烷;
(2)乙烯与溴发生加成反应生成1,2-二溴乙烷;
(3)乙烯与水加成生成乙醇;
(4)乙烯加成聚合生成聚乙烯;
(5)苯与液溴发生取代反应生成溴苯和溴化氢;
(6)苯与浓硝酸发生取代反应生成硝基苯和水;
(7)乙醇分子间脱水生成乙醚;
(8)醋酸与钠反应生成醋酸钠和氢气.
解答 解:(1)甲烷与氯气反应生成一氯甲烷,方程式:CH4+Cl2$\stackrel{光照}{→}$CH3Cl+HCl;
故答案为:CH4+Cl2$\stackrel{光照}{→}$CH3Cl+HCl;
(2)乙烯与溴发生加成反应生成1,2-二溴乙烷,方程式:CH2=CH2+Br-Br→CH2Br-CH2Br;
故答案为:CH2=CH2+Br-Br→CH2Br-CH2Br;
(3)乙烯与水加成生成乙醇,方程式:CH2=CH2 +H2O$\stackrel{催化剂}{→}$CH3CH2OH;
故答案为:CH2=CH2 +H2O$\stackrel{催化剂}{→}$CH3CH2OH;
(4)乙烯加成聚合生成聚乙烯,方程式: ;
;
故答案为: ;
;
(5)苯与液溴发生取代反应生成溴苯和溴化氢,方程式: ;
;
故答案为: ;
;
(6)苯与浓硝酸发生取代反应生成硝基苯和水,方程式:
故答案为:
(7)乙醇分子间脱水生成乙醚.方程式:2C2H5OH $→_{140℃}^{浓硫酸}$C2H5OC2H5+H2O;
故答案为:2C2H5OH $→_{140℃}^{浓硫酸}$C2H5OC2H5+H2O;
(8)醋酸与钠反应生成醋酸钠和氢气,方程式:2CH3COOH+2Na→2CH3COO-+H2↑;
故答案为:2CH3COOH+2Na→2CH3COO-+H2↑.
点评 本题考查有机反应的化学方程式的书写,掌握有机物结构特点及发生反应的机理是解题的关键,题目难度不大.


 每日10分钟口算心算速算天天练系列答案
每日10分钟口算心算速算天天练系列答案科目:高中化学 来源: 题型:选择题
| A. | 10B的质子数是10 | B. | 10B的中子数与核外电子数不同 | ||
| C. | 10B20是一种新合成的化合物 | D. | 10B20具有较强的化学活性 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 向AlCl3溶液中加入过量氨水 | B. | 向Al2(SO4)3溶液中加入过量KOH溶液 | ||
| C. | 向澄清石灰水中通入过量CO2 | D. | 向NaAlO2溶液中加入过量稀盐酸 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 在托盘天平两托盘上各放一片相同的纸,然后将NaOH放在纸片上进行称量 | |
| B. | 配制溶液时,若加水超过容量瓶刻度,应用胶头滴管将多余溶液吸出 | |
| C. | 用蒸馏水洗涤烧杯、玻璃棒2-3次,洗涤液也移入容量瓶中 | |
| D. | 定容时俯视容量瓶的刻度线,会造成所配溶液物质的量浓度偏低 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 分别中和pH相同的等体积的盐酸和醋酸溶液,消耗等量的NaOH | |
| B. | pH=a的CH3COOH溶液加水稀释10n倍后,pH=a+n | |
| C. | pH相等的CH3COONa、NaOH溶液中,水的电离程度相同 | |
| D. | Na2CO3溶液中:c(OH-)=c(H+)+c(HCO${\;}_{3}^{-}$)+2c(H2CO3) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
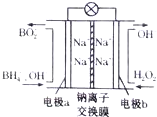 据报道,以硼氢化合物NaBH4(B元素的化合价为+3价)和H2O2作原料的燃料电池,其负极材料采用Pt/C,正极材料采用MnO2,可用作空军通信卫星电源,其工作原理如图所示.下列说法正确的是( )
据报道,以硼氢化合物NaBH4(B元素的化合价为+3价)和H2O2作原料的燃料电池,其负极材料采用Pt/C,正极材料采用MnO2,可用作空军通信卫星电源,其工作原理如图所示.下列说法正确的是( )| A. | 该电池的负极反应为BH4-+8OH--8e-═BO2-+6H2O | |
| B. | 电池放电时Na+从b极区移向a极区 | |
| C. | 每消耗3mol H2O2,转移的电子为3mol | |
| D. | 电极a采用Mn02作电极材料 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
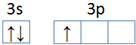 ,第一电离能:镁大于(填“大于”或“小于”)铝.
,第一电离能:镁大于(填“大于”或“小于”)铝.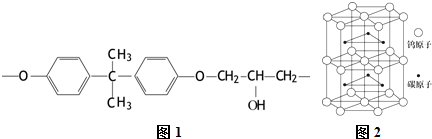
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
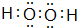 ,其所含化学键为(选代码)bc.
,其所含化学键为(选代码)bc.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com