
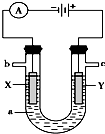
 如图表示一个电解池,装有电解液a;X、Y是两块电极板,通过导线与直流电源相连.
如图表示一个电解池,装有电解液a;X、Y是两块电极板,通过导线与直流电源相连.| 2.56g |
| 64g/mol |


科目:高中化学 来源: 题型:
| A、1:1 | B、2:1 |
| C、2:3 | D、3:2 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、13.6g |
| B、12g |
| C、6g |
| D、3.2 g |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、pH=4的醋酸中:c(H+)=4.0mol?L-1 |
| B、pH=12的纯碱溶液中:c(OH-)=1.0×10-2mol?L-1 |
| C、饱和食盐水中:c(Na+)+c(H+)=c(Cl-)+c(OH-) |
| D、饱和小苏打溶液中:c(Na+)=c(HCO3-) |
查看答案和解析>>
科目:高中化学 来源: 题型:
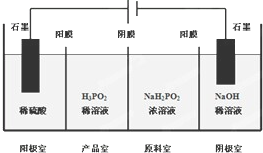 次磷酸(H3PO2)是一种精细磷化工产品,具有较强的还原性.回答下列问题:
次磷酸(H3PO2)是一种精细磷化工产品,具有较强的还原性.回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:
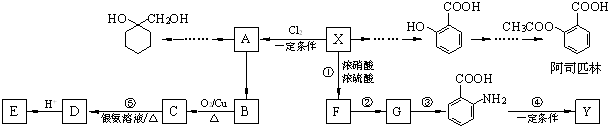
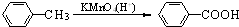
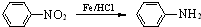 (苯胺,易被氧化)
(苯胺,易被氧化)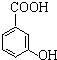 有多种同分异构体,写出同时符合下列4个条件它的同分异构体的结构简式:
有多种同分异构体,写出同时符合下列4个条件它的同分异构体的结构简式: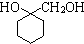 的流程图:
的流程图: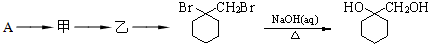 完成甲→乙的化学反应方程式:
完成甲→乙的化学反应方程式: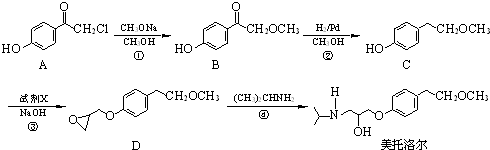
 为原料
为原料 的合成路线流程图(无机试剂任用).合成路线流程图示例如下:
的合成路线流程图(无机试剂任用).合成路线流程图示例如下:| HBr |
| NaOH溶液 |
| △ |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、①②③⑤⑦ |
| B、⑤②⑦③⑥ |
| C、⑤②①③④ |
| D、①②⑤③⑥ |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com