
| A. | 仅①③ | B. | 仅②④ | C. | 仅①③④ | D. | 仅①②③ |
分析 加热蒸干并灼烧的过程中,要注意考虑盐的水解平衡的移动、物质的氧化、物质的分解等情况,氯化铁易水解,硫酸亚铁易被氧化等.
解答 解:①FeCl3因为能水解生成Fe(OH)3,灼烧得Fe2O3,溶液加热蒸干并灼热不能得到原物质,故正确;
②碳酸钠在溶液在加热时水解得到碳酸氢钠与氢氧化钠,但氢氧化钠难挥发,最后得到的固体为Na2CO3,故错误;
③硫酸亚铁易被氧化为硫酸铁,加热蒸干得到的是硫酸铁,溶液加热蒸干并灼热不能得到原物质,故正确;
④硅酸钠中硅酸根离子水解得到硅酸,硅酸受热分解为二氧化硅,溶液加热蒸干并灼热不能得到原物质,故正确;
故选C.
点评 本题综合考查物质的性质,侧重于水解、分解等知识,题目难度不大,注意相关物质的性质的掌握.


科目:高中化学 来源: 题型:选择题
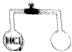 如图所示,已知两瓶容积相同,同温同压下,左瓶内充满氯化氢气体,当右瓶中充满下列混合气体中的某一组时,其所含原子总数与左瓶中所含原子总数一定相等,则该混合气体是( )
如图所示,已知两瓶容积相同,同温同压下,左瓶内充满氯化氢气体,当右瓶中充满下列混合气体中的某一组时,其所含原子总数与左瓶中所含原子总数一定相等,则该混合气体是( )| A. | O3、N2 | B. | CH4、NH3 | C. | N2、O2 | D. | CO、CO2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 所有的化学反应都有能量变化 | |
| B. | 需要加热的反应一定是吸热反应 | |
| C. | 所有的放热反应都可以在常温常压下自发进行 | |
| D. | 核能作为一种反应热,是理想的新能源 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 1:1:1 | B. | 2:1:1 | C. | 1:2:1 | D. | 1:1:3 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 2A(l)+B(l)═2C(g);△H=+Q1 | B. | 2A(g)+B(g)═2C(g);△H=+Q2 | ||
| C. | 2A(g)+B(g)═2C(l);△H=+Q3 | D. | 2A(l)+B(l)═2C(l);△H=+Q4 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
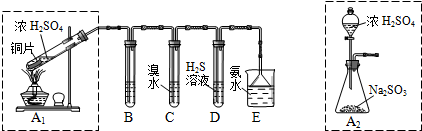
| 实验操作 | 预期现象与结论 |
| 步骤1:取适量“吸收液”于小烧杯中,用胶头滴管取l mol/L BaCl2溶液向小烧杯滴加直至过量. | 若出现白色浑浊,则溶液中存在SO32-或 SO42-. |
| 步骤2:将小烧杯中的浊液过滤、洗涤,再用适量水把附在滤纸上的固体冲入另一小烧杯中;向冲下的固体滴入1滴品红,再滴入过量2 mol/L盐酸,振荡 用试管取适量滤液,向其中滴入过量l mol/LBa(OH)2溶液(或1滴品红,再滴入2-3滴2 mol/L盐酸),振荡. 步骤3: | 若品红褪色(或有气泡)则存在SO32- 若出现白色沉淀(或品红褪色或有气泡),则存在HSO3- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
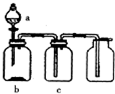 使用下表提供的试剂,利用如图所示的装置,能达到实验目的是( )
使用下表提供的试剂,利用如图所示的装置,能达到实验目的是( )| 选项 | a中试剂 | b中试剂 | c中试剂 | 实验目的 |
| A | 稀盐酸 | 铁粉 | H2O | 制备并收集H2 |
| B | 稀硫酸 | Na2SO3粉末 | 浓硫酸 | 制备并收集干燥的SO2 |
| C | 浓盐酸 | KmnO4粉末 | NaOH溶液 | 制备并收集Cl2 |
| D | 浓氨水 | 生石灰 | 碱石灰 | 制备并收集干燥的NH3 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
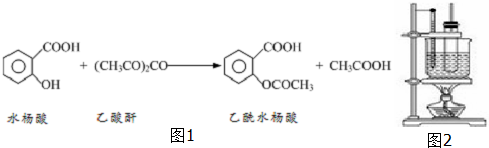
| 试剂 | 沸点(℃) | 溶解度 | 化学性质 |
| 乙酸酐 | 139 | 在水中逐渐分解 | 略 |
| 乙酰水杨酸 | 略 | 微溶于水 | 与碳酸钠反应生成水溶性盐 |
| 水杨酸 | 211 | 微溶于冷水,易溶于热水 | 略 |
| 乙酸 | 117.9 | 略 | 略 |
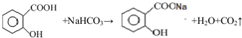 .
.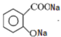 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
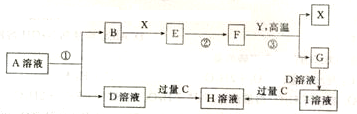
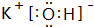 ,H的化学式为KHCO3;
,H的化学式为KHCO3;查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com