
 一定温度下,在2L的恒容密闭容器中,X、Y、Z三种气体的物质的量随时间变化的曲线如图所示:
一定温度下,在2L的恒容密闭容器中,X、Y、Z三种气体的物质的量随时间变化的曲线如图所示:分析 (1)根据各物质的物质的量与化学计量数成正比写出该反应方程式;
(2)根据v=$\frac{\frac{△n}{V}}{△t}$计算出从反应开始到10s时用Y表示的反应速率为;根据X消耗的物质的量及反应初始物质的量计算出其转化率;
(3)10s时各组分的浓度不再变化,说明达到平衡状态.
解答 解:(1)由图象可以看出,反应中X、Y的物质的量减少,应该为反应物,Z的物质的量增多,应为生成物,
当反应进行到10s时,△n(X)=0.79mol、△n(Y)=0.79mol、△n(Z)=1.58mol,则△n(X):△n(Y):△n(Z)=1:1:2,参加反应的物质的物质的量之比等于化学计量数之比,则反应的方程式为:X(g)+Y(g)?2Z(g),
故答案为:X(g)+Y(g)?2Z(g);
(2)从反应开始到10s时,Y的物质的量变化为:1.00mol-0.21mol=0.79mol,则该段时间内用Y表示的反应速率为:v(Y)=$\frac{\frac{0.79mol}{2L}}{10s}$=0.0395 mol•L-1•s-1;
该段时间内X消耗的物质的量为:1.20mol-0.41mol=0.79mol,则X的转化率为:$\frac{0.79mol}{1.20mol}$×100%=65.8%,
故答案为:0.0395 mol•L-1•s-1;65.8%;
(3)根据图示曲线变化可知,10s时X、Y、Z的物质的量不再变化,说明此事正逆反应速率相等,该反应已经达到平衡状态,
故答案为:是.
点评 本题考查了化学平衡的计算,题目难度中等,明确图象曲线变化的含义为解答关键,注意掌握化学平衡及其影响因素,试题培养了学生的分析能力及化学计算能力.


 千里马走向假期期末仿真试卷寒假系列答案
千里马走向假期期末仿真试卷寒假系列答案科目:高中化学 来源: 题型:选择题
| A. | c(H+)=c(CH3COO-)+c(OH-) | |
| B. | 加入少量CH3COONa固体后,c(CH3COO-)降低 | |
| C. | 该溶液中由水电离出的 c(H+)是 1.0×10-11mol/L | |
| D. | 与等体积pH=11 的NaOH 溶液混合后所得溶液显酸性 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 操作 | 现象或结果 |
| I.取m g 铁粉,在水蒸气中加热一段时间 | 灰黑色铁粉变成黑色 |
| II.用排水集气法收集一小试管气体,移近到燃着 的酒精灯火焰 | 发出爆鸣声 |
| III.将黑色固体干燥、称量 | 得到n g 黑色固体 |
| IV.将黑色固体加入到过量的盐酸中 | 固体溶解,有少量气体生成,得到黄色溶液 |
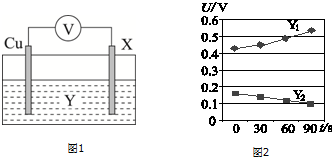
| X | U/V |
| 纯铁片 | 0.91 |
| 表面有磁性氧化铁膜的铁片 | U1 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 ,下列说法中不正确的是( )
,下列说法中不正确的是( )| A. | 该有机物属于饱和烷烃 | |
| B. | 该烃与2,5-二甲基-3-乙基己烷互为同系物 | |
| C. | 该烃的名称是3-甲基-5-乙基庚烷 | |
| D. | 该烃的一氯取代产物共有8种 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 过量CO2通入NaOH溶液中:CO2+2OH-═CO32-+H2O | |
| B. | 铜与足量浓硝酸反应:Cu+4H++2NO3-═Cu2++2NO↑+2H2O | |
| C. | 碳酸钠固体溶于水:CO32-+2H2O?H2CO3+2OH- | |
| D. | 钠与水反应:2Na+2H2O═2Na++2OH-+H2↑ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 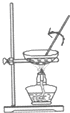 图:从FeCl2溶液中制取FeCl2晶体 | |
| B. | 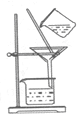 图:从制取Fe(OH)2胶体的混合物中提纯胶体 | |
| C. | 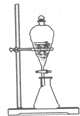 图:用CCl4萃取,从溴水中得到纯溴 | |
| D. | 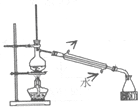 图:分离苯和甲苯 |
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
 某温度时,在一个2L的密闭容器中,X、Y、Z三种物质的物质的量随时间的变化曲线如图所示.根据图中数据填空:
某温度时,在一个2L的密闭容器中,X、Y、Z三种物质的物质的量随时间的变化曲线如图所示.根据图中数据填空:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 实验室制取乙酸乙酯的方程式为:CH3COOH+H18O-C2H5$?_{△}^{浓H_{2}SO_{4}}$CH3COOC2H5+H${\;}_{2}^{\;}$18O | |
| B. | 向某溶液中滴加KSCN溶液,溶液呈血红色,证明存在Fe3+而没有Fe2+ | |
| C. | 常温下浓硝酸与铝不反应,可用铝制容器存放浓硝酸 | |
| D. | 沉淀溶解达到平衡时,溶液中溶质的离子浓度不一定相等,但保持不变 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com