
 一定温度下,在三个容积为2.0L的恒容密闭容器中发生反应:
一定温度下,在三个容积为2.0L的恒容密闭容器中发生反应:| 容器 | 温度/℃ | 起始物质的量浓度/mol•L-1 | |||
| NO (g) | CO (g) | N2(g) | CO2(g) | ||
| 甲 | T1 | 0.10 | 0.10 | 0 | 0 |
| 乙 | T2 | 0 | 0 | 0.10 | 0.20 |
| 丙 | T2 | 0.10 | 0.10 | 0 | 0 |
| A. | 该反应的正反应为吸热反应 | |
| B. | 乙容器中反应达到平衡时,N2的转化率小于40% | |
| C. | 达到平衡时,乙容器中的压强一定大于甲容器的2倍 | |
| D. | 丙容器中反应达到平衡后,再充入0.10mol NO和0.10mol CO2,此时v(正)<v(逆) |
分析 A.先拐先平温度高,甲平衡状态二氧化碳物质的量小,说明温度越高平衡逆向进行;
B.丙中达到平衡状态二氧化碳0.12mol,结合三行计算得到
2NO(g)+2CO(g)?N2(g)+2CO2(g),
起始量(mol/L) 0.1 0.1 0 0
变化量(mol/L) 0.06 0.06 0.03 0.06
平衡量(mol/L) 0.04 0.04 0.03 0.06
乙若达到相同平衡状态,体积增大一倍,
2NO(g)+2CO(g)?N2(g)+2CO2(g),
起始量(mol/L) 0 0 0.05 0.1
变化量(mol/L) 0.04 0.04 0.02 0.04
平衡量(mol/L) 0.04 0.04 0.03 0.06
此时氮气转化率$\frac{0.02}{0.05}$×100%=40%,但相同体积条件下,相当于体积缩小压强增大平衡正向进行;
C.温度T1>T2,反应为放热反应,温度越低平衡正向进行,气体物质的量减小,气体压强减小,乙气体物质的量为甲的一倍,相当于增大压强,平衡正向进行,气体物质的量减小,
D.计丙容器中平衡浓度计算平衡常数,再充入0.10mol NO和0.10mol CO2,计算此时浓度商和平衡常数比较判断反应进行的方向.
解答 解:A.先拐先平温度高,甲平衡状态二氧化碳物质的量小,说明温度越高平衡逆向进行,逆反应为吸热反应,正反应为放热反应,故A错误;
B.丙中达到平衡状态二氧化碳0.12mol,
2NO(g)+2CO(g)?N2(g)+2CO2(g),
起始量(mol/L) 0.1 0.1 0 0
变化量(mol/L) 0.06 0.06 0.03 0.06
平衡量(mol/L) 0.04 0.04 0.03 0.06
乙若达到相同平衡状态,体积增大一倍,
2NO(g)+2CO(g)?N2(g)+2CO2(g),
起始量(mol/L) 0 0 0.05 0.1
变化量(mol/L) 0.04 0.04 0.02 0.04
平衡量(mol/L) 0.04 0.04 0.03 0.06
此时氮气转化率$\frac{0.02}{0.05}$×100%=40%,但相同体积条件下,相当于体积缩小压强增大平衡正向进行,氮气转化率小于40%,故B正确;
C.温度T1>T2,反应为放热反应,温度越低平衡正向进行,气体物质的量减小,气体压强减小,乙气体物质的量为甲的一倍,相当于增大压强,平衡正向进行,气体物质的量减小,达到平衡时,乙容器中的压强一定小于甲容器的2倍,故C错误;
D.2NO(g)+2CO(g)?N2(g)+2CO2(g),
起始量(mol/L) 0.1 0.1 0 0
变化量(mol/L) 0.06 0.06 0.03 0.06
平衡量(mol/L) 0.04 0.04 0.03 0.06
K=$\frac{0.0{6}^{2}×0.03}{0.0{4}^{2}×0.0{4}^{2}}$=42.19,
丙容器中反应达到平衡后,再充入0.10mol NO和0.10mol CO2,浓度商Qc=$\frac{(0.06+0.05)^{2}×0.03}{(0.04+0.05)^{2}×0.0{4}^{2}}$=28.14<K,平衡正向进行
此时v(正)>v(逆),故D错误;
故选B.
点评 本题考查了化学平衡影响因素分析、平衡常数、转化率计算、等效平衡的建立等,掌握基础是解题关键,题目难度中等.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:选择题
| 实验操作 | 实验现象 | 实验结论 | |
| A | 碳酸钠粉末中加入适量醋酸 | 产生无色无味的气体 | 醋酸的酸性比碳酸强 |
| B | 乙烯通入酸性高锰酸钾溶液中 | 溶液褪色 | 乙烯能被高锰酸钾氧化 |
| C | 点燃苯 | 火焰明亮,并带有浓烟 | 苯的含碳量高 |
| D | 石蕊溶液中滴入乙酸 | 石蕊溶液变红色 | 乙酸是强酸 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
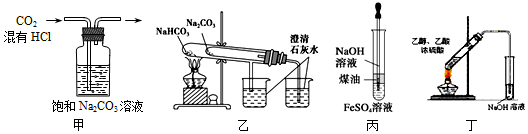
| A. | 图甲可除去CO2种混有的HCl气体 | |
| B. | 图乙可用于比较Na2CO3和NaHCO3的热稳定性 | |
| C. | 图丙可制得Fe(OH)2沉淀且一定时间内不变质 | |
| D. | 图丁可制得并分离出乙酸乙酯 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 ,下列有关该有机物说法正确的是( )
,下列有关该有机物说法正确的是( )| A. | 该有机物的化学式为C10H14 | |
| B. | 它的一氯代物有6种 | |
| C. | 它的分子中所有的碳原子一定在同一平面上 | |
| D. | 一定条件下,它可以发生取代、加成、氧化和还原反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
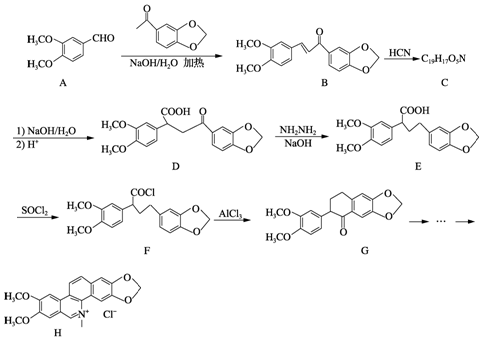
 ;由E→F的反应类型为取代.
;由E→F的反应类型为取代. .
. ,写出制备的合成路线流程图(无机试剂任用,合成路线流程图示例见本题题干).
,写出制备的合成路线流程图(无机试剂任用,合成路线流程图示例见本题题干).查看答案和解析>>
科目:高中化学 来源: 题型:解答题

 键
键查看答案和解析>>
科目:高中化学 来源: 题型:解答题

 +CH3Cl$\stackrel{AlCl_{3}}{→}$
+CH3Cl$\stackrel{AlCl_{3}}{→}$ +HCl
+HCl .
. .
. .
. .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
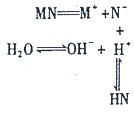
| A. | 该过程可表示MN的水解过程 | B. | 相同条件下结合H+的能力N->OH- | ||
| C. | 该过程使溶液中的c(OH-)>c(H+)] | D. | 溶液中存在c(HN)=c(OH-)-c(H+) |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com