
����Ŀ����֪ 25��ʱ����������ʵĵ���ƽ�ⳣ�����������
��ѧʽ | HSCN | CH3COOH | H2CO3 | HClO |
����ƽ�ⳣ�� | 1.3��10��1 | 1.8��10��5 | Ka1=4.3��10��1Ka2=5.6��10��1 | 3.0��10��8 |
�ش��������⣺
��1��д��̼�����Ҫ�ĵ��뷽��ʽ �� ����̼�ᱥ����Һϡ�� 10 ������ϡ�ͺ����Һ�� c��H+��ԭ����ʮ��֮һ������ڡ�����С�ڡ����ڡ�����
��2�����ʵ���Ũ�Ⱦ�Ϊ 0.1mol/L ��������Һ��pH ��С�����˳��Ϊ���ñ����д����
a��CH3COONa b��Na2CO3 c��NaClO d��NaHCO3 e��NaSCN
��3��25��ʱ���� 20mL0.1molL��1CH COOH ��Һ�� 20mL0.1molL��1HSCN ��Һ�ֱ��� 20mL0.1molL��1NaHCO ��Һ��ϣ�ʵ���ò��������������V����ʱ�䣨t���ı仯��ͼ��
��Ӧ��ʼ��������Һ���� CO2��������ʴ������Բ����ԭ������Ӧ�������� NaHCO3��ȫ��Ӧ������ȫ���ݳ�������������Һ�У�c��CH3COO��c��SCN�������������������=����
��4��25��ʱ��CH3COONa �� CH3COOH �Ļ����Һ������� pH=8������Һ��c��Na+����c��CH3COO����=mol/L����������ݺ�ļ���ʽ���������������ֵ����
��5���� NaClO ��Һ��ͨ�������� CO2 �� ������Ӧ�����ӷ���ʽΪ ��
���𰸡�
��1��H2CO3?H++HCO3��,����
��2��e��a��d��c��b
��3��HSCN�����Ա�CH3COOHǿ,����Һ��c��H+���ϴ�,������Һ��NaHCO3��Һ�ķ�Ӧ���ʿ�,��
��4��10��6��10��8
��5��ClO��+CO2+H2O�THClO+HCO3��
���������⣺��1��̼�����Ҫ�ĵ��뷽��ʽΪH2CO3H++HCO3����̼����Һ��ˮϡ�ͣ��ٽ�̼��ĵ��룬ϡ�ͺ����Һ�� c��H+�� ����ԭ����ʮ��֮һ��
���Դ��ǣ�H2CO3H++HCO3�������ڣ�
��2��������ĵ���ƽ�ⳣ����֪������HSCN��CH3COOH��H2CO3��HCN��HCO3��������Խ������������ӵ�ˮ��̶�Խ����ҺpHԽ�����Ե����ʵ���Ũ�ȵ�a��CH3COONa b��Na2CO3 c��NaClO d��NaHCO3 e��NaSCN��Һ��pH��С�����˳��Ϊe��a��d��c��b��
���Դ��ǣ�e��a��d��c��b��
��3����Ka��CH3COOH��=1.8��10��5��Ka��HSCN��=0.13��֪��CH3COOH����������HSCN�ģ�������ͬŨ�ȵ������HSCN��Һ��H+��Ũ�ȴ���CH3COOH��Һ��H+��Ũ�ȣ�Ũ��Խ��Ӧ����Խ�죻����Խ������Ӧ���ɵ���Ӧ������Խ��ˮ�⣬��c��CH3COO������c��SCN������
���Դ��ǣ�HSCN�����Ա�CH3COOHǿ������Һ��c��H+���ϴ�����Һ��NaHCO3��Һ�ķ�Ӧ���ʿ죻����
��4��CH3COOH��CH3COONa�Ļ����Һ�У����ڵ���غ㣺c��Na+��+c��H+��=c��OH����+c��CH3COO����������c��CH3COO������c��Na+��=c��H+����c��OH����=10��6mol/L��10��8mol/L��
���Դ��ǣ�10��6��10��8����5������ǿ��HClO��HCO3��������ǿ����ȡ����֪�����߷�Ӧ����̼�����ƺʹ����ᣬ���ӷ���ʽΪClO��+CO2+H2O�THClO+HCO3����
���Դ��ǣ�ClO��+CO2+H2O�THClO+HCO3����
�����㾫����������Ŀ����֪�������������������ˮ��Һ�еĵ���ƽ������֪ʶ���Եõ�����Ĵ𰸣���Ҫ���յ�������ʷ����������ӵ����ʵ��ڽ�ϳɷ��ӵ�����ʱ��������ʵĵ���ʹ��ڵ���ƽ��״̬������ƽ���ǻ�ѧƽ���һ�֣�ͬ�����л�ѧƽ��������������ı�ʱƽ���ƶ��Ĺ��ɷ�����ɳ����ԭ����


 ��У����ϵ�д�
��У����ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����֪X��Y��Z����Ԫ�ص�ԭ������֮�͵���42��XԪ��ԭ�ӵ�4p�������3��δ�ɶԵ��ӣ�YԪ��ԭ�ӵ������2p�������2��δ�ɶԵ��ӣ�X��Y���γɻ�����X2Y3 �� ZԪ�ؿ����γɸ�һ�����ӣ���ش��������⣺
��1��XԪ��ԭ�ӻ�̬ʱ�ĵ����Ų�ʽΪ �� ����Ԫ�ط�������
��2��YԪ��ԭ�ӵļ۲���ӵĵ����Ų�ͼΪ �� ��Ԫ�ص���������
��3���Ƚ�X���⻯����ͬ��ڶ�����������Ԫ�����γɵ��⻯���ȶ��ԣ���˵������ ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������£���Ũ��Ϊ 0.1mol/L�����Ϊ V L �İ�ˮ����μ��� 0.1mol/L �����ᣬ���� ��ѡ������ֵ�����У�������
A.![]()
B.![]()
C.![]()
D.![]()
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ijС��Ϊ�о��绯ѧԭ���������ͼװ�á�������������ȷ����

A. a��b������ʱ����Ƭ�ϻ��н���ͭ����
B. a��b�õ�������ʱ��ͭƬ�Ϸ����ķ�ӦΪCu2+ + 2e = Cu
C. a��b�õ������Ӻ���Һ�е�Cu2+��ͭ�缫�ƶ�
D. a��b�õ������Ӻ�FeƬ�Ϸ�����ԭ��Ӧ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����̼�Ļ�����֮���������ת������ش��������⣺
��1���л��� M ���й��ʱ�������ת���� N���������ͼ��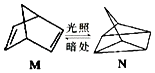
M �� N �����У�����ת��Ϊ�ܣ����н��ȶ������������� M��N �ش𣩣�
��2����֪ ![]() ��l����ȼ����Ϊ 3267.5kJmol��1 ��
��l����ȼ����Ϊ 3267.5kJmol��1 �� ![]() ��l��+6O 2��g���T6CO2 ��g��+3H2 ��g��
��l��+6O 2��g���T6CO2 ��g��+3H2 ��g��
��H=a kJmol��1 �� �� a��3267.5�����������������=������
��3���ڱ�״̬��ѹ��Ϊ 100kPa��һ���¶��£���Ԫ�����ȶ��ĵ����������� 1mol ���� ����ʱ�ķ�Ӧ�ȳ�Ϊ�û�����ı�Ħ�������ʣ���H��������֪ 100kPa��һ���¶��£�
Fe2O3��s��+3C��ʯī��=2Fe��s��+3CO��g����H=+490.0kJmol��1
CO��g��+ ![]() O2��g��=CO 2��g����H=��280.0kJmol��1
O2��g��=CO 2��g����H=��280.0kJmol��1
C��ʯī��+O2��g��=CO2 ��g����H=��390.5kJmol��1
�� Fe2O3�ı�Ħ�������ʡ�H= ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ij���л���������Fe2O3��Ϊ�缫�����Ʊ�����ӵ����һ��Ϊ����﮺�ʯī�ĸ��ϲ��ϣ������ֻ��������ӣ�ͨ���ڱ��������¶�����ڵ�ؽ���ѭ����ŵ磬�ɹ�ʵ���˶Դ��ԵĿ������(��ͼ)������˵����ȷ����

A. ����ʿ�����Li2SO4��Һ
B. ���ʱ��Fe��Ϊ��������ز�����������
C. �ŵ�ʱ��������ӦΪFe2O3+6Li++6e-==2Fe+3Li2O
D. ���ʱ��������ӦΪ:Li2O +2e-==2Li+O2-
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ʯ�ͺ�ú�п�������������ԭ��A��B��A��һ�ֹ�ʵ����������IJ������� ����һ�����ҵ�ʯ�ͻ�����չˮƽ��B��һ�ֱ�ˮ�����״Һ�壬����̼������Ԫ����ɣ�̼Ԫ������Ԫ�ص�������Ϊ12��1��B����Է�������Ϊ78���ش��������⣺
(1)A�Ľṹ��ʽ��________��
(2)Aʹ������Ȼ�̼��Һ��ɫ�Ļ�ѧ��Ӧ����ʽ��___________��
(3)�ڵ�ˮ�м���B���ú������_______________���ò�����______________��
(4)B��Ũ�����Ũ������50��60�淴Ӧ�Ļ�ѧ��Ӧ����ʽ��_________��
��Ӧ����Ϊ��_________________��
(5)��������A��B��ȫȼ��ʱ����O2�����ʵ���________���A>B������A<B����A��B������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ͨ�����SO2�����Ƿ�ﵽ�ŷű��ķ�Ӧԭ����SO2 +H2O2 + BaCl2 ===BaSO4��+ 2HCl��NA��ʾ����٤������������˵����ȷ���ǣ� ��
A. 0.1 mol BaCl2����������������Ϊ0.1NA
B. 25 ��ʱ��pH =1��HCl��Һ�к���H+����ĿΪ0.1NA
C. 17 g H2O2�к��зǼ��Լ���ĿΪ0.5NA
D. ����2.33 g BaSO4����ʱ��ת�Ƶ�����ĿΪ0.01NA
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ʵ������֤�����������̼������Ӧ����ȷ��������װ����ͼ��ʾ(��֪��PdC12��Һ��CO�ܲ�����ɫ��Pd)������˵���������

A. װ�âٵ�������������ȡH2��NH3������
B. װ�â���ʯ��ˮ����Ǻ��ٵ�ȼ�ƾ���
C. װ�âڢ��зֱ�ʢװ����Na2CO3��Һ��ŨH2SO4
D. װ�â����к�ɫ�����������ķ�Ӧ��PdC12+CO+H2O=Pd��+CO2+2HC1
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com