
分析 ①配制230mL 1mol•L-1的NaOH溶液,应选择250mL容量瓶,依据m=CVM计算需要溶质的质量;
⑥依据定容的正确操作解答;
(1)据配制溶液的实验操作过程进行实验步骤排序;
(2)依据配制溶液体积结合容量瓶规格选择合适容量瓶;
(3)根据c=$\frac{n}{V}$可得,一定物质的量浓度溶液配制的误差都是由溶质的物质的量n和溶液的体积V引起的,误差分析时,关键要看配制过程中引起n和V怎样的变化:若n比理论值小,或V比理论值大时,都会使所配溶液浓度偏小;若n比理论值大,或V比理论值小时,都会使所配溶液浓度偏大.
(4)根据实验过程中出现任何误差引起浓度变化都要重新配制.
解答 解:①配制230mL 1mol•L-1的NaOH溶液,应选择250mL容量瓶,实际配制250mL溶液,需要溶质的质量m=CVM=1mol/L×40g/mol×0.25L=10.0g;
故答案为:10.0;
⑥定容时,向容量瓶中加入蒸馏水到刻度线下1-2cm时,改用胶头滴管滴加蒸馏水至凹液面最低点与刻度线相切;
故答案为:1-2;胶头滴管;
(1)配制1mol•L-1的NaOH溶液250mL,配制步骤有计算、称量、溶解、移液、洗涤移液、定容、摇匀等操作,用天平称量NaOH(用到药匙),在烧杯中稀释,并用玻璃棒搅拌,加速溶解,冷却后转移到250mL容量瓶中,并用玻璃棒引流,洗涤2-3次,并将洗涤液移入容量瓶,当加水至液面距离刻度线1~2cm时,改用胶头滴管滴加,最后定容颠倒摇匀,所以操作顺序为:①②④③⑥⑤;
故答案为:①②④③⑥⑤;
(2)没有230mL容量瓶,需要选择250mL容量瓶,实际配制1mol•L-1的NaOH溶液250mL;
故答案为:C;
(3)①溶解氢氧化钠固体的烧杯没有洗涤,导致部分溶质损耗,溶质的物质的量偏小,溶液浓度偏低;
②搅拌以加速溶解时不小心洒出一小滴溶液,导致部分溶质损耗,溶质的物质的量偏小,溶液浓度偏低;
③定容时俯视观察液面,导致溶液体积偏小,溶液浓度偏高;
故选:偏低;偏低;偏高;
(4))①定容后摇匀发现凹液面最低点低于刻度线,是由于溶液粘在刻度线以上,属于正常现象,对溶液的物质的量浓度无影响,所以无需处理,
故答案为:无需处理;
②向容量瓶中转移溶液时不慎将少量溶液洒在容量瓶外不做处理,溶质的物质的量偏小,根据c=$\frac{n}{V}$可知该氢氧化钠的物质的量浓度偏低,
故答案为:重新配制.
点评 本题考查了配制一定物质的量浓度的溶液方法,题目难度不大,注意掌握配制一定浓度的溶液方法,能够根据配制步骤选用仪器,注意依据C=$\frac{n}{V}$进行误差分析的判断.


 怎样学好牛津英语系列答案
怎样学好牛津英语系列答案科目:高中化学 来源: 题型:选择题
| A. | CO2的电子式: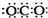 | B. | 核内有8个中子的碳原子:${\;}_{6}^{8}$C | ||
| C. | 甲烷的结构简式:CH4 | D. | 乙烯分子的球棍模型: |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | σ键是轴对称的,π键是镜像对称的 | |
| B. | σ键是“头碰头”式重叠,π键是“肩并肩”式重叠 | |
| C. | σ键不能断裂,π键容易断裂 | |
| D. | H原子只能形成σ键,O原子可以形成σ键和π键 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ③④⑤⑥⑦ | B. | ③④⑥ | C. | ④⑥⑦ | D. | ①③④⑤ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
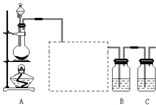 已知非金属单质硫(S)是淡黄色固体粉末,难溶于水.为了验证氯元素的非金属性比硫元素的非金属性强,某化学实验小组设计了如下实验,请回答下列问题:
已知非金属单质硫(S)是淡黄色固体粉末,难溶于水.为了验证氯元素的非金属性比硫元素的非金属性强,某化学实验小组设计了如下实验,请回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①⑥ | B. | ②③④ | C. | ②③④⑤ | D. | ③④⑤⑥ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 乙酸和甲酸甲酯 | B. | 乙烷和乙醛 | ||
| C. | 甲醛和麦芽糖(C12H22O11) | D. | 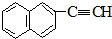 和 和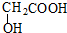 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com