
【题目】H2C2O4(草酸)为二元弱酸,在水溶液中H2C2O4、HC2O4-和C2O42-物质的量分数与pH关系如图所示,下列说法不正确的是
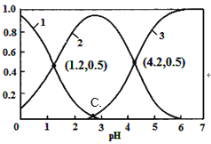
A.根据图中数据计算可得C点溶液pH为2.7
B.向草酸溶液中滴加氢氧化钠溶液至pH为4.2时c(Na+)+c(H+)=3c(C2 O42-)+c(OH-)
C.0.1 mol·L-1NaHC2O4溶液中c(Na+)>c(HC2O4-)>c(H+)>c(OH-)
D.当混合溶液呈中性时,c(Na+)>c(HC2O4-)> c(C2 O42-) >c(H+)=c(OH-)
【答案】D
【解析】
A.由图中信息可知Ka1=10-1.2,Ka2=10-4.2,C点H2C2O4 和C2O42-相等,而Ka1Ka2=![]() =10-5.4,c(H+)=10-2.7,A正确;
=10-5.4,c(H+)=10-2.7,A正确;
B.向草酸溶液中滴加氢氧化钠溶液至pH为4.2时,根据电荷守恒c(Na+)+c(H+)=2c(C2 O42-)+c(OH-) + c(HC2O4-),在此点,c(C2 O42-)= c(HC2O4-),B正确,
C.Ka2=10-4.2,HC2O4-的水解常数为10-12.8,HC2O4-的电离大于水解,溶液呈酸性,C正确;
D.当c(HC2O4-)=c(C2 O42-)时,溶液呈酸性,若溶液呈中性,则c(HC2O4-)<c(C2 O42-),D错误;
故选D。


科目:高中化学 来源: 题型:
【题目】a、b、c、d、e为原子序数依次增大的五种常见短周期元素,可组成一种化合物A,其化学式为ba4d(ec4)2。A能够发生如下转化关系:

己知C的分子式为ba3,能使湿润的红色石蕊试纸变蓝。则下列说法正确的是
A.原子半径b>c
B.e的氧化物的水化物为强酸
C.化合物A为共价化合物
D.元素非金属性强弱c<e
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】2019年诺贝尔化学奖花落锂离子电池,美英日三名科学家获奖,他们创造了一个可充电的世界。像高能LiFePO4电池,多应用于公共交通。电池中间是聚合物的隔膜,主要作用是在反应过程中只让Li+通过。结构如图所示。

原理如下:(1x)LiFePO4+xFePO4+LixCn![]() LiFePO4+nC。下列说法不正确的是( )
LiFePO4+nC。下列说法不正确的是( )
A.放电时,正极电极反应式:xFePO4+xLi++xe-=xLiFePO4
B.放电时,电子由负极经导线、用电器、导线到正极
C.充电时,阴极电极反应式:xLi++xe-+nC=LixCn
D.充电时,Li+向左移动
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】钨是高熔点金属,工业上用主要成分为FeWO4和MnWO4的黑钨铁矿与纯碱共熔冶炼钨的流程如下,下列说法不正确的是( )
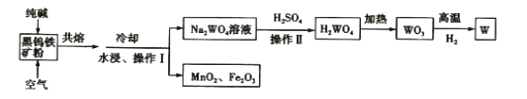
A.将黑钨铁矿粉碎的目的是增大反应的速率
B.共熔过程中空气的作用是氧化Fe(II)和Mn(II)
C.操作II是过滤、洗涤、干燥,H2WO4难溶于水且不稳定
D.在高温下WO3被氧化成W
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列装置能达到实验目的的是
选项 | A | B | C | D |
实验装置 |
|
|
|
|
实验目的 | 探究Na2CO3和NaHCO3溶解度的相对大小 | 用已知浓度的NaOH溶液滴定未知浓度的稀硫酸 | 检验蔗糖与浓硫酸反应产生的CO2 | 验证镁和稀盐酸的反应的热效应 |
A. A B. B C. C D. D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】决定物质性质的重要因素是物质结构。请回答下列问题:
(1)已知元素M是组成物质Ca5(PO4)3F的一种元素。元素M的气态原子逐个失去第1个至第5个电子所需能量(即电离能,用符号I1至I5表示)如表所示:
电离能 | I1 | I2 | I3 | I4 | I5 |
电离能/(kJ·mol-1) | 589.8 | 1145.4 | 4912.4 | 6491 | 8153 |
元素M化合态常见化合价是________价,其基态原子电子排布式为________________。
(2)Ca3(PO4)3F中非金属元素电负性由大到小的顺序为________________。
(3)PO43-的中心原子的杂化方式为________,该离子的空间构型为________,键角为________,其等电子体有________(请写出两种)。
(4)已知MgO与CaO的晶体结构相似,其摩氏硬度的大小关系为________,原因为__________________。
(5)CaF2晶胞结构如图所示,则CaF2晶体中与Ca2+最近且等距离的Ca2+数目为________;已知Ca2+和F-半径分别为a cm、b cm,阿伏加德罗常数为NA,M为摩尔质量,则晶体密度为________ g·cm-3(不必化简)。
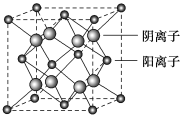
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】科学家最近在-100℃的低温下合成一种烃X,烃X分子的结构如图所示(图中的连线表示化学键)。下列说法正确的是( )
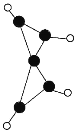
A.充分燃烧等质量的X和甲烷,X消耗的氧气较多
B.X是一种常温下能稳定存在的液态烃
C.X和乙烷类似,都易发生取代反应,不易发生加成反应
D.X既能使溴的四氯化碳溶液褪色又能使酸性KMnO4溶液褪色
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】反应A2+3B2 =2AB3在2L的密闭容器中进行,5s后,A2的物质的量增加了0.3mol,则此反应的平均速率可表示为:
A.v (A2)=0.01 mol/(L·s)B.v (B2)=0.08 mol/(L·s)
C.v (AB3)=0.03 mol/(L·s )D.v (AB3)=0.06 mol/(L·s )
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】离子液体是一种由离子组成的液体,在低温下也能以液态存在,是一种很有研究价值的溶剂。研究显示最常见的离子液体主要由图示正离子和负离子组成:
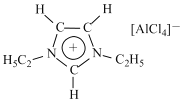
回答下列问题:
(1)按电子排布,Al划分在元素周期表中的______区(填“s”“p”“d”或“ds”),图中负离子的空间构型为____________________。
(2)基态Cl原子的价电子排布图为____________________。
(3)图中正离子有令人惊奇的稳定性, 它的电子在其环外结构中高度离域。该正离子中C原子的杂化方式为_________。该化合物中不存在____(填标号)。
A.离子键 B.极性键 C.非极性键 D.配位键 E.氢键
(4)C、N、H三种元素的电负性由大到小的顺序为 __________,NH3与CH4的中心原子均为 sp3杂化,但是H-N-H 的键角小于H-C-H的键角,原因是________。
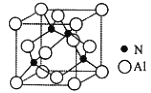
(5)AlN是一种陶瓷绝缘体,具有较高的导热性和硬度, 其立方晶胞如图所示,Al原子周围紧邻的Al原子有_____个。已知:氮化铝的密度为dg/cm3, 阿伏加德罗常数为NA,则最近的N原子与Al原子间的距离为_____________pm。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com