
分析 (1)铁钉(碳素钢)放入冷浓硫酸中,浓硫酸有较强的氧化性能使铁钉钝化;
(2)①溶液中同时存在铁离子和亚铁离子,需要用酸性高锰酸钾溶液检验亚铁离子;
②生成的SO2具有还原性,通入足量溴水中,发生SO2+Br2+2H2O=2HBr+H2SO4,利用硫元素的守恒,结合关系式:SO2→BaSO4求出SO2的体积分数.
解答 解:(1)铁钉(碳素钢)放入冷浓硫酸中,浓硫酸有较强的氧化性能使铁钉钝化阻止反应进一步进行,
故答案为:铁表面被钝化;
(2)①甲同学认为X中除Fe3+外还可能含有Fe2+,若要确认其中存在Fe2+,需要用酸性高锰酸钾溶液检验,方法为:取少量溶液X于试管中,滴入几滴酸性高锰酸钾溶液,若高锰酸钾溶液的紫色褪去,则说明溶液中含有Fe2+,
故答案为:取少量溶液X于试管中,滴入几滴酸性高锰酸钾溶液,若高锰酸钾溶液的紫色褪去,则说明溶液中含有Fe2+;
②SO2具有还原性,通入足量溴水中,发生SO2+Br2+2H2O=2HBr+H2SO4,
n(混合气体)=$\frac{0.336L}{22.4L/mol}$=0.015mol,
SO2 →BaSO4
1mol 233g
n 2.33g
n=0.01mol
则 SO2的体积分数:$\frac{0.01}{0.015}$×100%=66.7%,
故答案为:因为n(BaSO4)=n(SO2)=0.01mol,而336mL(标准状况)气体的物质的量为0.015mol,所以SO2的体积分数为:$\frac{0.01}{0.015}$×100%=66.7%.
点评 本题综合考查元素化合物知识、提出假设并设计实验方案的能力和文字表达能力,开放性较强,涉及:浓硫酸的强氧化性,C、S与Fe及其化合物的性质,题目难度中等.


科目:高中化学 来源: 题型:计算题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | P-P键的键能大于P-Cl键的键能 | |
| B. | 可求Cl2(g)+PCl3(g)═PCl5(s)的反应热△H | |
| C. | Cl-Cl键的键能$\frac{b-a+5.6c}{4}$ kJ•mol-1 | |
| D. | 1molP4含4molp-p键 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 多余的氯气可以用氢氧化钠溶液吸收 | |
| B. | 用澄清的石灰石可以鉴别CO2和SO2 | |
| C. | SO2、Cl2都能使品红溶液褪色,其原理不同 | |
| D. | 铁丝在氯气中燃烧生成三价铁 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
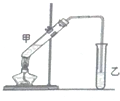 俗话说,“陈酒老醋特别香”,其原因是酒在储存过程中生成了有香味的乙酸乙酯,在实验室里我们也可以用如图所示的装置来模拟该过程.请回答下列问题:
俗话说,“陈酒老醋特别香”,其原因是酒在储存过程中生成了有香味的乙酸乙酯,在实验室里我们也可以用如图所示的装置来模拟该过程.请回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
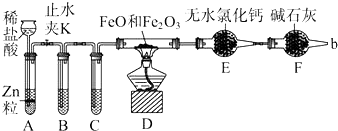
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
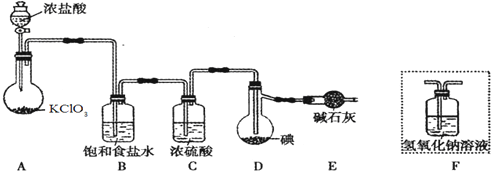
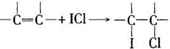
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com