
【题目】烯烃是重要的有机化合物.其中乙烯是最简单的一种烯烃,其产量代表着一个国家石油化工产业的水平。
完成下列问题:
(1)实验室用如图所示装置制取乙烯,反应方程式是____,无水乙醇与浓硫酸的体积比为1:3,请解释加入浓硫酸不宜过少的原因是__。
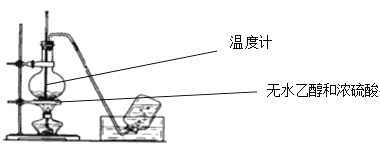
(2)反应需要迅速升温至所需温度的理由是___。所以烧瓶中应放入的固体物质是___,其作用是____。
(3)烯烃通过催化加氢可以得到烷烃。请写出一种可以通过催化加氢反应得到2,2-二甲基丁烷的结构简式:___。
(4)有一种烷烃A,分子式C9H20,它却不能由任何C9H18的烯烃催化加氢得到。请写出A的结构简式___,在A的同分异构体中,却存在只能由1种烯烃催化加氢得到的烷烃,请写出一种符合要求的A的同分异构体的结构简式:___。
烯烃还可以与卤素单质、卤化氢、水发生加成反应,产物有主次之分,例如:
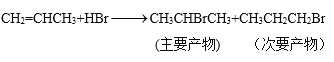
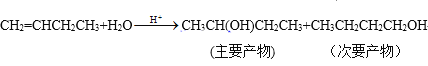
(5)化学式为C4H8的某烃A与HBr加成得到的主要产物,其一氯代物只有一种,请写出A发生聚合反应的方程式:___。
【答案】C2H5OH![]() CH2=CH2↑+H2O ①硫酸的浓度逐渐降低,脱水性变弱,②副反应会消耗H2SO4 ①温度低于170℃时容易发生副反应,生成乙醚②温度高于170℃时生成CO2 碎瓷片或沸石 防止暴沸 (CH3)3C-CH=CH2
CH2=CH2↑+H2O ①硫酸的浓度逐渐降低,脱水性变弱,②副反应会消耗H2SO4 ①温度低于170℃时容易发生副反应,生成乙醚②温度高于170℃时生成CO2 碎瓷片或沸石 防止暴沸 (CH3)3C-CH=CH2 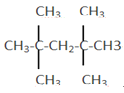 (CH3)3C-C(CH3)2-CH2-CH3或(CH3)2CH-C(CH3)2-CH(CH3)2或C(CH2-CH3)4
(CH3)3C-C(CH3)2-CH2-CH3或(CH3)2CH-C(CH3)2-CH(CH3)2或C(CH2-CH3)4 ![]()
【解析】
(1)实验室制取乙烯的化学方程式是C2H5OH![]() CH2=CH2↑+H2O,如果浓硫酸的量过少,随着反应的进行,浓度会变稀脱水性变弱;
CH2=CH2↑+H2O,如果浓硫酸的量过少,随着反应的进行,浓度会变稀脱水性变弱;
(2)反应需要迅速升温至所需温度的理由是①温度低于170℃时容易发生副反应,生成乙醚②温度高于170℃时生成CO2,加热时为了防止液体暴沸,应向液体中加入碎瓷片或者沸石;
(3)2,2-二甲基丁烷的结构简式(CH3)3C-CH2-CH3,根据碳原子的成键特点,变成烯烃后对应的烯烃是(CH3)3C-CH=CH2;
(4)烷烃A,分子式C9H20,它却不能由任何C9H18的烯烃催化加氢得到,则A中相邻的两个碳原子上不都含有H原子,故A的结构简式为:(CH3)3C-CH2-C(CH3)3;
另有A的三个同分异构体却分别可由而且只能由一种自己相应的烯烃催化加氢得到,则A同分异构体中相邻的两个碳原子上含有氢原子的位置只有1种情况,符合条件的A的同分异构体为:(CH3)3C-C(CH3)2-CH2-CH3或(CH3)2CH-C(CH3)2-CH(CH3)2或C(CH2-CH3)4;
(5)CH3CH=CHCH3加成只有一产物,方程式为![]() 。
。


 中考解读考点精练系列答案
中考解读考点精练系列答案科目:高中化学 来源: 题型:
【题目】氯化亚铁是重要的还原剂,常用于检测硒、生产聚合氯化铝铁絮凝剂。制备FeCl2的方法有多种。请回答下列问题:
Ⅰ.结晶法制取FeCl2
在一定浓度的盐酸中,逐渐加入过量的铁屑,充分反应后,蒸发至出现晶膜,____,______,固液分离,洗涤,快速干燥制得。
Ⅱ.氯苯还原无水FeC13制取FeC12
无水FeCl3与氯苯反应的化学方程式为:2FeCl3+C6H5Cl![]() 2FeCl2+C6H4Cl2+HCl↑
2FeCl2+C6H4Cl2+HCl↑
(1)如图是用干燥的C12和铁粉制取无水FeC13的装置。硬质玻璃管和收集器用大口管连接的原因是________。
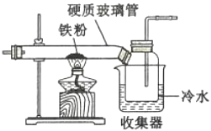
(2)利用如图装置制备无水FeC12,并检测FeC13的转化率。已知相关物质的部分性质如下:

C6H5C1(氯苯) | C6H4C12 | FeC13 | FeC12 | |
相对分子质量 | 112.5 | 147 | 162.5 | 127 |
熔点/℃ | -45 | 53 | 306 | 670~674 |
沸点/℃ | 132 | 173 | 315 | 1023 |
将162.5 g无水氯化铁和200 g氯苯加入到圆底烧瓶中,在锥形瓶中加入200 g滴有酚酞的9.5%的NaOH溶液。先通入N2一段时间,再加热,控制温度在132 ℃左右发生反应。实验完成后冷却,分离提纯得到粗产品。
①先通入N2的目的是_______;导管a的作用是______。
②当锥形瓶内溶液颜色由红色变为无色时,停止加热,则氯化铁转化率理论上达到或超过______%。
③实验结束后,回收过量氯苯的操作名称为______。
④指出装置c可能存在的缺点______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化学与环境、科学、技术密切相关。下列有关说法中正确的是( )
A.华为首款5G手机搭载了智能的7nm制程SoC麒麟980芯片,此芯片主要成分是二氧化硅
B.用于制作N95型口罩的“熔喷布”主要原料是聚丙烯,聚丙烯的分子长链上无支链
C.国产飞机C919用到的氮化硅陶瓷是传统有机非金属材料
D.侯氏制碱法的工艺过程中应用了物质溶解度的差异
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铁系元素是人体必需的微量元素, Fe3+可以与KSCN溶液、苯酚等发生显色作用。镁元素也是人体所必需的阳离子元素之一,它能够维持核酸结构的稳定性,调节机体免疫功能,对人体抵抗新冠病毒等病毒侵袭起着重要作用。
(1)Fe3+的基态核外电子排布式为____________________。
(2)与SCN互为等电子体且为非极性分子的化学式为__________(任写一种)。
(3)普鲁士蓝俗称铁蓝,晶胞如图甲所示(K+未画出),平均每两个晶胞立方体中含有一个K+,又知该晶体中铁元素有+2价和+3价两种,则Fe3+与Fe2+的个数比为_________。

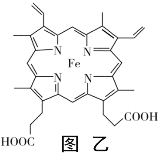
(4)血红素铁(图乙)用作铁强化剂,其吸收率比一般铁剂高3倍,在图乙中画出Fe2+与N原子间的化学键(若是配位键,需要用箭头加以表示)______________
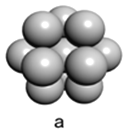
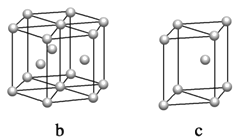
(5)镁单质晶体中原子的堆积模型如图,它的堆积模型名称为____________;晶胞是图中的_________________(填a、b或c);配位数是__________________;紧邻的四个镁原子的中心连线构成的正四面体几何体的体积是2a cm3,镁单质的密度为ρ g·cm-3,已知阿伏伏德罗常数为NA,则镁的摩尔质量的计算式是________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】亚硝酰氯(ClNO)是有机物合成中的重要试剂,可由NO与Cl2在常温常压下反应得到。ClNO部分性质如下:黄色气体,熔点:-59.6℃,沸点:-6.4℃,遇水易水解。某研究性学习小组根据亚硝酰氯(ClNO)性质拟在通风橱中制取亚硝酰氯,设计了如下实验装置。、

试回答下列问题:
(1)写出实验室利用装置A制备Cl2的离子反应方程式___。
(2)装置B的作用是①__,②___。
(3)若用A装置制取NO气体,B中应该盛放__。
(4)为使NO和Cl2恰好完全反应生成ClNO,理论上向E中通入NO和Cl2两种气体的流速比为__。
(5)装置H吸收尾气,有同学认为尾气中的某种气体不能完全被吸收。为了充分吸收尾气,可将尾气与__同时通入NaOH溶液中。
(6)已知:ClNO与H2O反应生成HNO2和HCl。
①设计实验证明HNO2是弱酸:__。(仅提供的试剂:1molL-1HCl、1molL-1HNO2溶液、NaNO2溶液、红色石蕊试纸、蓝色石蕊试纸)。
②通过以下实验测定ClNO样品的纯度。取F中所得液体3.0g溶于水,配制成250mL溶液;取出25.00mL样品溶液置于锥形瓶中,用0.20molL-1AgNO3标准溶液滴定至终点,根据表中所给信息,应选用___做指示剂。
物质 | Ag2CrO4 | AgCl | AgI | Ag2S |
颜色 | 砖红色 | 白色 | 黄色 | 黑色 |
Ksp | 1×10-12 | 1.56×10-10 | 8.3×10-17 | 6.3×10-50 |
消耗标准AgNO3溶液的体积为20.00ml,亚硝酰氯(ClNO)的质量分数为__。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列指定微粒数目一定相等的是( )
A.等质量的15N2与12C16O中的分子数
B.等质量的C2H4与C3H6中含有的碳原子数
C.等体积、等浓度的NH4Cl与(NH4)2SO4溶液中的NH![]() 数
数
D.等质量的Fe与Cu分别与足量Cl2反应时转移的电子数
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】为解决污染、变废为宝,我国科研人员研究在新型纳米催化剂Na-Fe3O4和HMCM-22的表面将CO2转化为烷烃,其过程如图。

下列说法中,不正确的是( )
A.反应I、II、III均有副产物H2O产生
B.最终产物X、Y属于同系物
C.产物X名称为“2—甲基丁烷”或“异戊烷”
D.产物X、Y都有4种一氯代物(不考虑立体异构体)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知反应:3Cu+8HNO3(稀)=3Cu(NO3)2+2NO↑+4H2O。
(1)参加反应的HNO3和作为氧化剂的HNO3的个数比为________。
(2)若有64 g Cu被氧化,则被还原的HNO3的质量是________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某硫酸厂产生的烧渣(主要含Fe2O3、FeO,还含有一定量的SiO2)可用于制备FeCO3,其流程如下:
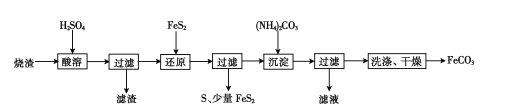
已知:“还原”时,FeS2与H2SO4不反应。
(l)“酸溶”时Fe2O3发生的化学反应方程式为________
(2)实验室“过滤”时所用的玻璃仪器有烧杯、________
(3)“还原”时生成S的离子方程式为________
(4)检验FeCO3是否洗净的方法是________
(5)“滤液”中的溶质可能有____(填化学式)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com