
| A. | 已知2H2(g)+O2(g)═2H2O(g)△H=-483.6kJ•mol-1说明2molH2(g)和1molO2(g)的能量总和小于2molH2O(g)的能量 | |
| B. | 已知C(石墨,s)=C(金刚石,s);△H>0,则金刚石比石墨稳定 | |
| C. | 已知NaOH(aq)+HCl(aq)═NaCl(aq)+H2O(l)△H=-57.4kJ•mol-1,则含20gNaOH的稀溶液与稀盐酸完全中和,放出28.7kJ的热量 | |
| D. | 已知2C(s)+2O2(g)═2CO2(g)△H1; 2C(s)+O2(g)=2CO(g)△H2;则△H1>△H2 |
分析 A.该反应为放热反应,说明反应物总能量大于生成物总能量;
B.物质具有的能量越高,该物质的稳定性越弱,结合该反应为吸热反应分析;
C.根据n=$\frac{m}{M}$计算出20g氢氧化钠的物质的量,然后结合题中的热化学方程式进行计算;
D.碳完全燃烧时放出热量较大,焓变为负值,放出热量越大,焓变越小.
解答 解:A.反应2H2(g)+O2(g)═2H2O(g)△H=-483.6kJ•mol-1为放热反应,说明2molH2(g)和1molO2(g)的能量总和大于2molH2O(g)的能量,故A错误;
B.已知C(石墨,s)=C(金刚石,s)△H>0,该反应为吸热反应,说明石墨具有的能量小于金刚石,则金刚石不如石墨稳定,故B错误;
C.20g氢氧化钠的物质的量为:$\frac{20g}{40g/mol}$=0.5mol,根据NaOH(aq)+HCl(aq)═NaCl(aq)+H2O(l)△H=-57.4kJ•mol-1可知,20gNaOH的稀溶液与稀盐酸完全中和,放出热量为:57.4kJ•mol-1×0.5mol=28.7kJ,故C正确;
D.已知2C(s)+2O2(g)═2CO2(g)△H1; 2C(s)+O2(g)=2CO(g)△H2;前者碳完全燃烧,后者不完全燃烧,则前者放出热量较大,由于焓变为负值,则△H1<△H2,故D错误;
故选C.
点评 本题考查了热化学方程式的书写及应用,题目难度中等,反应热与焓变及物质稳定性与具有能量的关系为解答关键,注意掌握热化学方程式的书写原则,D为易错点,注意焓变为负值,试题培养了学生的灵活应用能力.


 名牌学校分层周周测系列答案
名牌学校分层周周测系列答案 黄冈海淀全程培优测试卷系列答案
黄冈海淀全程培优测试卷系列答案科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | 该溶液中存在H2S分子 | |
| B. | 该溶液中H+的浓度是S${\;}_{2}^{2-}$浓度的2倍 | |
| C. | 向该溶液中加入足量的硝酸能产生H2S气体 | |
| D. | 向该溶液中加入过量的NaOH溶液可得到含大量NaHS2的混合溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | CO(g)的燃烧热是283.0 kJ/mol,则表示CO燃烧热的热化学方程式为2CO(g)+O2(g)═2CO2(g);△H=-566.0 kJ/mol | |
| B. | 由石墨比金刚石稳定可知:C(金刚石,s)=C(石墨,s);△H<0 | |
| C. | 需要加热才能发生的反应一定是吸热反应 | |
| D. | 已知:2SO2 (g)+O2(g)?2SO3 (g);△H=-98.3 kJ/mol.将1 mol SO2和0.5 mol O2充入一密闭容器中反应,放出49.15 kJ的热量 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
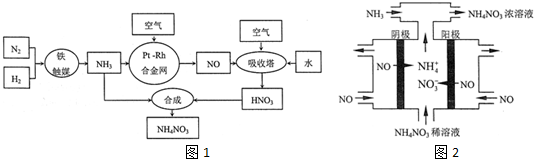
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 2H2(g)+O2(g)═2H2O(l)△H=-571.6kJ•mol-1 | |
| B. | 2H2(g)+O2(g)═2H2O(l)△H=-142.9kJ•mol-1 | |
| C. | 2H2(g)+O2(g)═2H2O (g)△H=-571.6kJ•mol-1 | |
| D. | 2H2(g)+O2(g)═2H2O (l)△H=+571.6kJ•mol-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
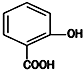
| A. | 可能含有两个醛基 | B. | 可能含有三个羟基 | ||
| C. | 都能与氢氧化钠溶液反应 | D. | 分子式都是C7H6O3 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 浓硫酸起了催化剂、吸水剂的作用 | |
| B. | 加热55-60℃通常通过水浴来实现 | |
| C. | 由于苯和硝酸都易挥发,所以通常需要加冷凝装置 | |
| D. | 纯净的硝基苯为淡黄色比水重的液体 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com