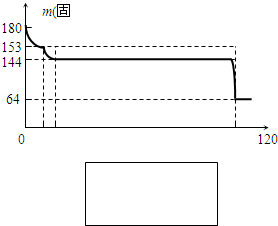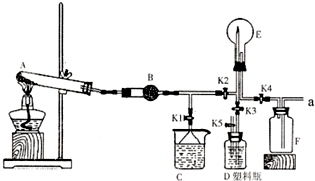
如图是实验室中某种气体的制备、性质检验及收集装置图.
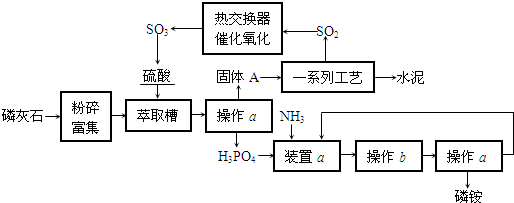
(1)写出A装置中反应的化学方程式
2NH
4Cl+Ca(OH)
2CaCl
2+2NH
3↑+2H
2O
2NH
4Cl+Ca(OH)
2CaCl
2+2NH
3↑+2H
2O
.
(2)B装置的作用是
干燥氨气
干燥氨气
.
(3)做喷泉实验前,要检验F装置是否充满气体,该操作及现象是
用湿润的红色石蕊试纸靠近a处,如试纸变为蓝色,则F中的已充满氨气(或用玻璃棒蘸取浓盐酸靠近a处,如产生白烟,则F中充满氨气)
用湿润的红色石蕊试纸靠近a处,如试纸变为蓝色,则F中的已充满氨气(或用玻璃棒蘸取浓盐酸靠近a处,如产生白烟,则F中充满氨气)
.
(4)做喷泉实验时要关闭K2和K4,打开K1,此时C装置的作用有两点:①吸收多余的气体保证气流通畅.②
防止发生倒吸现象
防止发生倒吸现象
.
(5)验满气体后,关闭K2和K4,打开K1.若要在E中引发喷泉,其操作为
关闭K5,打开K3,轻轻挤压塑料瓶D,然后打开K5(或打开K1和K5,用手(或热毛巾、或冷毛巾将烧瓶捂住)
关闭K5,打开K3,轻轻挤压塑料瓶D,然后打开K5(或打开K1和K5,用手(或热毛巾、或冷毛巾将烧瓶捂住)
;假设液体充满整个烧瓶,在标准状况下所得溶液的物质的量浓度为
0.045mol/L
0.045mol/L
.

 如图是实验室中某种气体的制备、性质检验及收集装置图.
如图是实验室中某种气体的制备、性质检验及收集装置图.

 口算题卡加应用题集训系列答案
口算题卡加应用题集训系列答案 综合自测系列答案
综合自测系列答案