
2003年诺贝尔化学奖授予了美国科学家Peter Agre和Roderick Mackinnon以表彰他们在“水通道”和“离子通道”的研究成就。Mackinnon教授的研究内容主要是Na+、K+体积很接近,但在生物体内呈现的差别却高达1万倍,他革命性的让科学家观测Na+、K+在进入离子通道前、通道中以及穿过通道后的状态,可为病人在“离子通道”中寻找具体的病因,并研制相应药物。下列关于钠、钾的说法正确的是
A.单质钠的密度比钾的密度小 B.Na+和K+常用作氧化剂
C.钠和钾都是短周期元素 D.钠和钾的合金[ω(K)=50%~80%]在室温下呈液态
 应用题作业本系列答案
应用题作业本系列答案科目:高中化学 来源: 题型:
把等物质的量的Cu、Fe粉投入一定量的FeCl3溶液中充分反应后取出部分溶液,
(1)若滴加一滴KSCN溶液,溶液显红色,则溶液中存在的离子有_________。
(2)若加一滴KSCN溶液,溶液不显红色,则溶液中一定存在的离子有_________,可能存在的金属粉末有_________。
(3)若加入的金属全部溶解,则溶液中n(Cu2+):n(Fe2+)是_________。
(4)若(3)反应后的溶液中有3种金属离子,欲从中回收Cu和FeCl3,需要用到的试剂有(按反应顺序填写)___________________________。
(5)在500mL 0.1 mol·L-1 的FeCl2溶液中通入一定量Cl2,待反应结束后,将溶液稀释到1 L,再取出1/10稀溶液加入足量的AgNO3溶液,得到2.009g沉淀。原溶液中被氧化的Fe2+的物质的量为__________mol;若将剩余的Fe2+全部氧化,还需加入0.5 mol·L-1 的稀硝酸_________ mL。
查看答案和解析>>
科目:高中化学 来源: 题型:
X、Y、Z、W、R、Q是6种短周期元素,其原子序数依次增大。X是周期表中原子半径最小的元素,Y原子最外层电子数是次外层电子数的3倍,Z、W、R、Q处于同一周期,R与Y处于同一族,Z、W原子的核外电子数之和与Y、R原子的核外电子数之和相等。下列说法不正确的是
A.同周期元素的离子中W离子半径最小
B.元素X能与元素Y形成共价化合物X2Y2
C.工业上用二氧化锰和浓盐酸制取Q的单质
D.元素Z、W、R的最高价氧化物对应的水化物之间均能反应
查看答案和解析>>
科目:高中化学 来源: 题型:
常温下有0.1 mol·L-1五种溶液NaOH、 NH3·H2O、 CH3COOH 、HCl、NH4HSO4。
(1)已知CH3COOH溶液的pH=3,其电离度为 ,由水电离的c(H+)= 。
(2)相同pH的CH3COOH溶液和HCl溶液加水稀释,其pH变化情况如
 图,其中表示HCl溶液的是曲线 ,a、b两点中,导
图,其中表示HCl溶液的是曲线 ,a、b两点中,导
电能力更强的是 。
(3)NH3·H2O溶液和HCl溶液等体积混合后,溶液呈酸性的原因是(离子方程式表示) 。此时,该混合溶液中的微粒浓度关系正确的是 。
A.c(Cl-)>c(H+) >c(NH4+)>c(OH-) B.c(Cl-)=c(NH4+)>c(OH-)=c(H+)
C.c(NH4+)+ c(NH3·H2O)= 0.1mol·L-1 D.c(H+) = c(NH3·H2O)+c(OH-)
(4)已知NH3·H2O和NH4Cl等浓度混合时溶液呈碱性,向NH4HSO4溶液中逐滴滴入NaOH溶液至中性时,溶液中各离子浓度的大小关系是 。
查看答案和解析>>
科目:高中化学 来源: 题型:
氧化还原反应在生产、生活中具有广泛的用途。下列生产、生活中的事例不属于氧化还原反应的是( )
A.金属冶炼 B.燃放鞭炮 C.食物腐败 D.点制豆腐
查看答案和解析>>
科目:高中化学 来源: 题型:
下列物质中:
(1)互为同分异构体的有 (2)互为同素异形体的有
(3)属于同位素的有 (4)属于同一种物质的有 。(填序号)
①液氯 ②  ③白磷 ④氯气 ⑤
③白磷 ④氯气 ⑤
⑥ Cl ⑦
Cl ⑦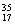 Cl ⑧红磷
Cl ⑧红磷
查看答案和解析>>
科目:高中化学 来源: 题型:
欲从苯酚的乙醇溶液中分离苯酚和乙醇,有下列操作:
①过滤 ②蒸馏 ③静置分液
④加入足量的金属钠 ⑤加入足量的NaOH溶液 ⑥通入过量的二氧化碳
⑦加入足量的FeCl3 溶液 ⑧加入乙酸与浓硫酸混合液加热。
合理的实验操作步骤及顺序是( )
A. ④⑤③ B. ⑥①⑤③ C. ⑧①⑦③ D. ⑤②⑥③
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com