
| A. | 银氨溶液 | B. | 新制氢氧化铜 | C. | 氯化钡溶液 | D. | 碘水 |
 云南师大附小一线名师提优作业系列答案
云南师大附小一线名师提优作业系列答案科目:高中化学 来源: 题型:选择题
| A. | CO2、CH4、N2等均是造成“温室效应”的气体 | |
| B. | 天然气是一种清洁的化石燃料 | |
| C. | 节能减排符合“低碳经济”的要求 | |
| D. | 合理开发利用“可燃冰”(固态甲烷水合物)有助于缓解能源紧缺 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | “可燃冰”给我们提供了水可以变油的证据 | |
| B. | CH4•(H2O)n属于氧化物 | |
| C. | “可燃冰”是燃烧值高,没有污染的新能源 | |
| D. | 开采不当可造成比二氧化碳更严重的温室效应 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 反应时间/h | 1 | 4 | 9 | 16 | 25 |
| MgO层厚/nm | 0.05a | 0.2a | 0.45a | 0.8a | 1.25a |
| NiO层厚/nm | b | 2b | 3b | 4b | 5b |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①②③④ | B. | ①②③⑤ | C. | ①③④ | D. | ③④ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1 mol H2O的质量为18g/mol | |
| B. | 11.2L氯气所含的分子数为0.5NA | |
| C. | 0.1mol/L的Na2CO3溶液中所含Na+的物质的量为0.2mol | |
| D. | 常温常压下,1mol氦气含有的核外电子数为2NA |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
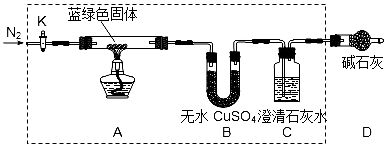
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com