
| A. | pH减小 | B. | $\frac{c(N{H}_{4}^{+})}{c(O{H}^{-})}$增大 | ||
| C. | 水的电离程度先减小后增大 | D. | Kb(NH3•H2O)不变 |
分析 向氨水中加入盐酸,盐酸和一水合氨反应生成氯化铵和水,酸或碱抑制水电离,含有弱根离子的盐促进水电离,一水合氨的电离平衡常数只与温度有关,与溶液的酸碱性无关.
解答 解:A.向氨水中加入盐酸,氢离子和氢氧根离子反应导致溶液中氢氧根离子浓度减小,溶液的PH减小,故A正确;
B.氢离子和氢氧根离子反应促进一水合氨的电离,导致溶液中铵根离子浓度增大,氢氧根离子浓度减小,所以$\frac{c(N{{H}_{4}}^{+})}{c(O{H}^{-})}$增大,故B正确;
C.一水合氨能电离出氢氧根离子,氯化氢能电离出氢离子,所以氨水和盐酸都抑制水电离,氯化铵是强酸弱碱盐能促进水电离,所以水的电离是先增大后减小,故C错误;
D.一水合氨的电离平衡常数只与温度有关,温度不变,一水合氨的电离平衡常数不变,故D正确;
故选C.
点评 本题考查弱电解质的电离,根据弱电解质的电离特点及影响弱电解质电离的因素来分析解答即可,难度中等.


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:解答题
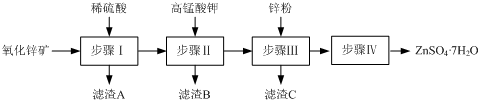
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
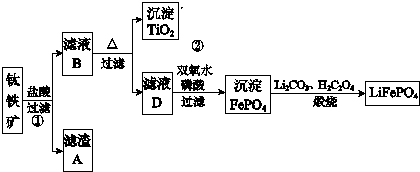
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
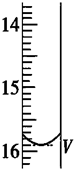 滴定分析是一种操作简便、准确度很高的定量分析方法,它可广泛应用于中和滴定、氧化还原反应等滴定中.某研究性学习小组的同学利用滴定分析法进行下面两项定量分析.
滴定分析是一种操作简便、准确度很高的定量分析方法,它可广泛应用于中和滴定、氧化还原反应等滴定中.某研究性学习小组的同学利用滴定分析法进行下面两项定量分析.| 滴定次数 | 待测液的体积(mL) | 滴定前的读数(mL) | 滴定后的读数(mL) |
| 第一次 | 25.00 | 0.00 | V=15.90 |
| 第二次 | 25.00 | 0.00 | 14.99 |
| 第三次 | 25.00 | 0.00 | 15.01 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 操作 | 现象 |
| 向盛有4g Na2O2的烧杯中加入50mL蒸馏水得到溶液a | 剧列反应,产生能使带火星木条复燃的气体 |
| 取5mL溶液a于试管中,滴入两滴酚酞 | ⅰ.溶液变红 ⅱ.10分种后溶液颜色明显变浅,稍后,溶液变为无色 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1molD(氘)的质量与NA个T(氚)的质量相等 | |
| B. | NA个氧分子和NA个氢分子的质量比为16:1 | |
| C. | 28g氮气所含原子数目为2NA | |
| D. | 在标准状况下,0.5NA个氯气分子所占的体积约是11.2L |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com