
下列有关热化学方程式的叙述中,正确的是
A.含20.0 g NaOH的稀溶液与稀盐酸完全中和,放出28.7 kJ的热量,该反应的热化学方
程式是 NaOH(aq)+HCl(aq)=NaCl(aq)+H2O(l) △H=+57.4 kJ·mol-1
B.已知C(石墨,s)=C(金刚石,s) △H>0,则金刚石一定比石墨稳定
C.已知2H2O(g)=2H2(g)+O2(g) △H=+483.6 kJ·mol-1,则提供483.6 kJ热量时,一定会使2 mol H2O (g)发生分解
D. 已知C(s)+O2(g)=CO2(g) △H=a kJ·mol-1,2C(s)+O2(g)=2CO(g), △H=b kJ·mol-1,则2CO(g)+O2(g)=2CO2(g) △H=(2a﹣b) kJ·mol-1
科目:高中化学 来源: 题型:
在含有弱电解质的溶液中,往往有多个化学平衡共存。
(1)一定温度下,向1 L 0.1 mol·L-1CH3COOH溶液中加入0.1 mol CH3COONa固体,溶液中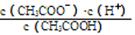 (填“增大”、“减小”或“不变”);写出表示该混合溶液中所有离子浓度之间的一个等式 。
(填“增大”、“减小”或“不变”);写出表示该混合溶液中所有离子浓度之间的一个等式 。
(2)土壤的pH一般在4~9之间。土壤中Na2CO3含量较高时,pH可以高达10.5,试用离子方程式解释土壤呈碱性的原因 。加入石膏(CaSO4·2H2O)可以使土壤碱性降低,有关反应的化学方程式为 。
(3)常温下向20 mL 0.1 mol·L-1Na2CO3溶液中逐滴加入0.1 mol·L-1HCl溶液40 mL,溶液中含碳元素的各种微粒(CO2因逸出未画出)物质的量分数随溶液pH变化的情况如下:
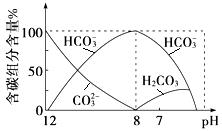
回答下列问题:
①在同一溶液中,H2CO3、HCO3-、CO32- (填“能”或“不能”)大量共存;
②当pH=7时,溶液中含碳元素的主要微粒有 、 ,溶液中含量最多的三种微粒的物质的量浓度的大小关系为 ;
查看答案和解析>>
科目:高中化学 来源: 题型:
在一定温度下,反应A2(g)+B2(g) 2AB(g)达到平衡的标志是
2AB(g)达到平衡的标志是
A.容器内的总压不随时间变化
B.单位时间生成nmol的A2同时生成2nmol的AB
C.单位时间生成2nmol的AB同时消耗nmol的B2
D.单位时间生成nmol的A2同时生成nmol的B2
查看答案和解析>>
科目:高中化学 来源: 题型:
一定温度下,在恒容密闭容器中发生如下反应:2X(g)+Y(g) 3Z(g),若反应开始时充入2mol X和2mol Y,达平衡后Y的体积分数为a%。其他条件不变时,若按下列四种配比作为起始物质,平衡后Y的体积分数>a%的是
3Z(g),若反应开始时充入2mol X和2mol Y,达平衡后Y的体积分数为a%。其他条件不变时,若按下列四种配比作为起始物质,平衡后Y的体积分数>a%的是
A.1molY,1molZ B.2mol X,1molY,1molN2
C.1molY和3molZ D.2molZ
查看答案和解析>>
科目:高中化学 来源: 题型:
高温条件下反应达到平衡时的平衡常数 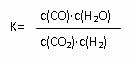 。恒容条件下升高温度,H2浓度减小。则下列说法正确的是
。恒容条件下升高温度,H2浓度减小。则下列说法正确的是
A.反应的热化学方程式可表示为:CO(g)+H2O(g) CO2(g)+H2(g) △H<0 kJ/mol
CO2(g)+H2(g) △H<0 kJ/mol
B.恒温恒容下,增大压强,H2浓度一定减小
C.升高温度,逆反应速率减小 D.该反应的正反应为放热反应
查看答案和解析>>
科目:高中化学 来源: 题型:
仅用下表提供的玻璃仪器(非玻璃仪器任选)或实验装置就能实现相应实验目的的是( )
| 选项 | A | B | C | D |
| 实验 目的 | 除去KCl中少量MnO2 | 用10 mol·L-1盐酸配制100 mL 0.1 mol·L-1盐酸 | 用NaCl溶 液制备氯 化钠晶体 | 除去乙烯中少量SO2 |
| 实验仪器或装置 | 烧杯、玻璃 棒、分液漏斗 | 100 mL容量瓶、玻璃棒、烧杯 |
|
|
查看答案和解析>>
科目:高中化学 来源: 题型:
由2溴丙烷为原料制取1,2丙二醇,需要经过的反应为
( )
A.加成—消去—取代 B.消去—加成—取代
C.消去—取代—加成 D.取代—消去—加成
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com