
【题目】恒容密闭容器中进行的可逆反应2NO2![]() 2NO +O2,可作为达到平衡状态的标志是( )
2NO +O2,可作为达到平衡状态的标志是( )
①单位时间内生成amo1O2的同时生成2amolNO2 ;
②单位时间内生成amolO2的同时生成2amolNO;
③混合气体的颜色不再改变;
④混合气体的密度不再改变的状态;
⑤混合气体的平均相对分子质量不再改变的状态;
⑥容器内的压强不再改变。
A.①②③④⑤B.②④⑤⑥C.①③④⑥D.①③⑤⑥
【答案】D
【解析】
判断化学平衡状态的两种方法
(1)动态标志:v正=v逆≠0
①同种物质:同一物质的生成速率等于消耗速率;
②不同物质:必须标明是“异向”的反应速率关系。如aA+bBcC+dD,![]() 时,反应达到平衡状态。
时,反应达到平衡状态。
(2)静态标志:各种“量”不变
①各物质的质量、物质的量或浓度不变;
②各物质的百分含量(物质的量分数、质量分数等)不变;
③温度、压强(化学反应方程式两边气体体积不相等)或颜色(某组分有颜色)不变;
以及由此衍生的一些物理量也不变,总之,“变化的量”不变了,可作为判断平衡的标志,据此解答。
①单位时间内生成amolO2的同时生成2amolNO2,生成amolO2表示正反应方向,生成2amolNO2表示逆反应方向,其速率之比等于化学计量数之比,说明反应达到平衡,故①正确;
②单位时间内生成amolO2的同时生成2amolNO,这都是正反应速率,没有说明逆反应方向的速率,故不能判断是否达到平衡,故②错误;
③混合气体的颜色不再改变,说明各物质浓度不再变化,说明反应达到平衡,故③正确;
④该反应的反应条件是恒容密闭容器,体积和质量都不变,所以整个过程中,混合气体的密度始终不变,不能作为平衡的标志,故④错误;
⑤混合气体的总质量不变,该反应前后气体总物质的量变化,则混合气体的平均相对分子质量是一个随着反应变化的量,因此混合气体的平均相对分子质量不再改变,说明反应达到平衡,故⑤正确;
⑥该反应的反应条件是恒容密闭容器,该反应前后气体总物质的量变化,则容器内的压强是一个随着反应进行变化的量,则容器内的压强不再改变,说明反应达到平衡,故⑥正确;
综上所述,①③⑤⑥可作为达到平衡状态的标志,D项正确;
答案为D。


科目:高中化学 来源: 题型:
【题目】下列说法正确的是( )
A.萘(![]() )是最简单的稠环芳香烃,萘与足量氢气充分加成的产物一氯代物有2种
)是最简单的稠环芳香烃,萘与足量氢气充分加成的产物一氯代物有2种
B.酚酞的结构如图所示,其结构中含有羟基(—OH),故酚酞属于醇
![]()
C.溴水能将 甲苯、己烯、CCl4、乙醇四种溶液鉴别开来
D. ![]() 的名称为2-甲基-戊醇
的名称为2-甲基-戊醇
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】加碘食盐中含碘酸钾(KIO3),化学兴趣小组对加碘食盐展开研究性学习。
(1)加碘食盐中KIO3的制备可以采用以下两种方法:
方法一:碘单质与KClO3溶液反应生成KIO3和Cl2;
方法二:碘单质与H2O2在催化剂作用下反应生成HIO3,再与K2CO3作用生成KIO3;两种方法制等质量的KIO3,理论上消耗KClO3和H2O2的物质的量之比为 _______ 。
(2)兴趣小组测定食用精制盐中碘元素含量的实验步骤为:
步骤1:准确称取25.00 g食盐,加适量蒸馏水使其完全溶解,配成100.00 mL溶液;
步骤2:取所配溶液25.00 mL于锥形瓶中,用稀硫酸酸化该溶液,加入足量KI溶液,使之充分反应;
步骤3:滴入2~3滴淀粉溶液作指示剂,用1.0×10-3 mol·L-1的Na2S2O3标准溶液滴定至终点,恰好完全反应时消耗12.00 mL标准溶液。
已知步骤3中所发生反应的离子方程式为I2+2S2O32-=2I-+S4O62-。
①步骤3中滴定终点的现象是 _______ 。
②下列情况会使测定结果偏大的是 _______ 。
A 装Na2S2O3标准溶液的滴定管水洗后未用Na2S2O3标准溶液润洗
B 装Na2S2O3标准溶液的滴定管滴定前有气泡,滴定终了无气泡
C 滴定时未充分振荡,溶液局部变色就终止
D 若其他读数正确,滴定结束读数时俯视
③计算该精制盐的碘元素含量(mg·kg-1),写出计算过程_______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一氧化碳是一种重要的化工原料。结合所学知识回答下列问题:
(1)工业上可通过CO和H2化合制取CH3OH:
CO(g)+2H2(g)![]() CH3OH(g) △H1
CH3OH(g) △H1
已知:①CO(g)+H2O(g)=CO2(g)+H2(g) △H2=-41.1kJ·mol-1
②CO2(g)+3H2(g)=CH3OH(g)+H2O(g) △H3=-49.0kJ·mol-1
则△H1=___。
(2)二氧化碳的回收利用是环保领域研究的热点课题。
在太阳能的作用下,以CO2为原料制取炭黑的流程如图所示。其总反应的化学方程式为___。
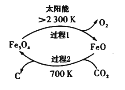
(3)工业上还可通过CO和Cl2化合制取光气(COCl2):Cl2(g) +CO(g)=COCl2(g) △H。向密闭容器中充入1molCl2(g)和1molCO(g),反应速率随温度的变化如图所示。
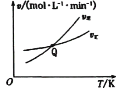
①图中Q点的含义是___,△H___0(填“>”或“<”)。
②某温度下,该反应达到平衡时c(COCl2)=0.80molL-1,c(Cl2)=0.20molL-1,则平衡体系中CO的体积分数为___(保留2位小数)。在该温度下,反应的平衡常数K=___。
(4)以稀硫酸为电解质溶液,利用太阳能将CO2转化为低碳烯烃,工作原理如图:
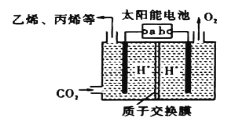
①b电极的名称是___。
②生成丙烯(C3H6)的电极反应式为___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】甲醇是一种重要的化工原料,在化工领域有广泛应用。
(1)甲醇燃料电池由于结构简单、能量转化率高、对环境天污染,可作为常规能源的替代品而越来越受到关注。其工作原理如如图所示:
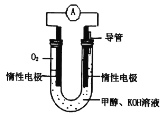
①该电池正极的电极反应为___,放电过程中负极区域溶液的pH值___(填“变大”或“变小”或“不变”)。
②该电池总反应的化学方程式为___。
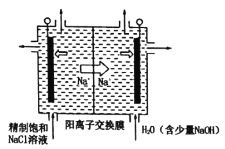
(2)二氧化氯(ClO2)为一种黄绿色气体,是国际上公认的高校、光谱、安全的杀菌消毒剂。目前已开发出用电解法制取ClO2的新工艺。
①如图中用石墨作电极,在一定条件下电解饱和食盐水制取ClO2。则阳极产生ClO2的电极反应式为____。
②电解一段时间,当阴极产生的气体体积为112mL(标准状况)时,停止电解。通过阳离子交换膜的阳离子的物质的量为___mol。
(3)英国《自然》杂志近期报道了一种新型铝离子电池,以金属铝和石墨为电极,用A1Cl4-和有机阳离子构成电解质溶液,其放电工作原理如图所示。
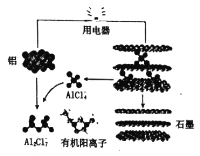
①电池放电时负极的电极反应式为___。
②充电时有机阳离子向___电极移动(填“铝”或“石墨”)。
③电池充电时,电路中每转移0.15mol电子,理论上生成___g铝。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】金属钒被誉为“合金的维生素”。从废钒(主要成分为V2O5、Fe2O3、SiO2等)中回收V2O5的一种工艺流程如下图所示:

已知:
步骤②、③中的变化过程可简化为:Rn+(水层)+nHA(有机层)![]() RAn(有机层)+nH+(水层)(式中Rn+表示VO2+或Fe3+,HA表示有机萃取剂)
RAn(有机层)+nH+(水层)(式中Rn+表示VO2+或Fe3+,HA表示有机萃取剂)
回答下列问题:
(1)步骤D酸浸过程中发生氧化还原反应的化学方程式为______________________。
(2)萃取时应加入适量碱的作用是___________________。
(3)步骤④中反应的离子方程式为___________________。
(4)步骤⑤加入氨水调节溶液pH=2,钒沉淀率达到93%且不产生Fe(OH)3沉淀,则此时溶液中c(Fe3+)<_____mol/L(按25℃计算,25℃时Ksp[Fe(OH)3]=2.6×10-39)。所得NH4VO3为离子化合物,NH4+的电子式为_______。
(5)V2O5是两性氧化物,在强酸性溶液中以VO2+形式存在,VO2+具有强氧化性,能将I-氧化为I2,本身被还原为V0+,则V2O5与氢碘酸反应的离子方程式为_________________。
(6)为提高钒的回收率,步骤②和③需多次进行,假设酸浸所得“强酸性浸出液”中c(VO2+)=amol/L,步骤②和③每进行一次,VO2+萃取率为80%,4次操作后,“强酸性浸出液中”c(VO2+)=_______mol/L(萃取的量=![]() )
)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某同学设计了蔗糖与浓硫酸反应的改进装置,并对气体产物进行检验,实验装置如图所示。下列结论中正确的是( )
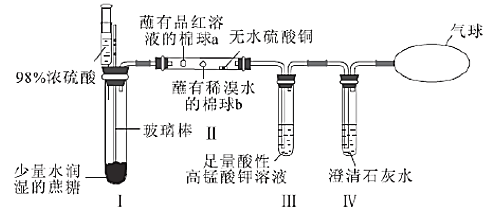
选项 | 现象 | 结论 |
A. | Ⅰ中注入浓硫酸后,可观察到试管中白色固体变为黑色 | 体现了浓硫酸的吸水性 |
B. | Ⅱ中观察到棉球a、b都褪色 | 均体现了SO2的漂白性 |
C. | Ⅱ中无水硫酸铜变蓝 | 说明反应产物中有H2O |
D. | Ⅲ中溶液颜色变浅,Ⅳ中澄清石灰水变浑浊 | 说明有CO2产生 |
A.AB.BC.CD.D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】明代《天工开物》记载了“火法”冶炼锌的方法:“炉甘石十斤,装载入一泥罐内,…然后逐层用煤炭饼垫盛,其底铺薪,发火煅红,…冷淀,毁罐取出,…,即倭铅也”,现代工业开发了用NH3—NH4Cl水溶液浸出氧化锌烟灰(主要成分为ZnO 、少量Pb、CuO和As2O3)制取高纯锌的工艺流程如图所示。
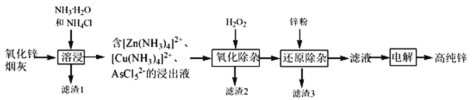
请回答下列问题:
(1)《天工开物》中炼锌的方法中“泥封”的目的是____________。
(2)滤渣1的主要成份分别是_______(填化学式),“过滤”用到的玻璃仪器是__________。
(3) “溶浸”时,氧化铜参与反应的相关离子方程式是________;“溶浸”时可以适当升高温度,但不宜过高,其原因是________________。
(4) “氧化除杂”的目的是将AsCl52-转化为As2O5胶体,再经吸附聚沉除去,溶液始终接近中性,该反应的离子方程式是_____________________。
(5) “电解”含 [Zn(NH3)4]2+的溶液,阴极放电的电极反应式是_________。阳极区产生一种无色无味的气体,将其通入滴有KSCN的FeCl2溶液中,无明显现象,该气体是_______(写化学式)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】相同温度、相同浓度下的八种溶液,其pH由小到大的顺序如图所示,图中①②③④⑤代表的物质可能分别为
![]()
A. NH4Cl (NH4)2SO4 CH3COONa NaHCO3 NaOH
B. (NH4)2SO4 NH4Cl CH3COONa NaHCO3 NaOH
C. (NH4)2SO4 NH4Cl NaOH CH3COONa NaHCO3
D. CH3COOH NH4Cl (NH4)2SO4 NaHCO3 NaOH
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com