
【题目】A、B、C、D、E、F、G、I均为前四周期原子序数依次增大的元素。A原子的L电子层的p能级上有一个空轨道;C的最外层有6个运动状态不同电子;D的基态原子外围电子排布式为3S2;E与D同周期,且在该周期中电负性最大;F、G是同族且原子序数差2的元素;I的基态原子外围只有一个单电子。
(1) 下列关于A2H4分子和H2C2分子的说法正确的是 。
A.分子中都含有σ键和π键 B.中心原子都sp2杂化
C.都是含极性键和非极性键的非极性分子
D.互为等电子体 E.A2H4分子的沸点明显低于H2C2分子
(2)A、B、C三种元素中的两种,能形成原子个数比为l:3的常见微粒,推测这两种微粒的空间构型为 。
(3)E能形成多种含氧酸,如HEO3、HEO2,请简述酸性HEO3大于HEO2的原因: 。
(4) G与AC能形成挥发性液体G(AC)4,则其固体属于 晶体。
(5) F常见晶体结构为体心立方堆积,原子半径为a nm,I常见晶体结构为面心立方堆积,原子半径为b nm,则两种金属的密度比为 (用含a、b的算式表示)。
(6) 已知Ti3+可形成配位数为6,颜色不同的两种配合物晶体,一种为紫色,另一种为绿色。两种晶体的组成皆为TiCl3·6H2O。为测定这两种晶体的化学式,设计了如下实验:
a.分别取等质量的两种配合物晶体的样品配成待测溶液;
b.分别往待测溶液中滴入AgNO3溶液,均产生白色沉淀;
c.沉淀完全后分别过滤得两份沉淀,经洗涤干燥后称量,发现原绿色晶体的水溶液得到的白色沉淀质量为原紫色晶体的水溶液得到的沉淀质量的2/3。则绿色晶体配合物的化学式为________________,由Cl-所形成的化学键类型是________。
【答案】(1)E
(2)平面三角形
(3)HClO3中非羟基氧多,Cl正电性高,导致羟基中O的电子向Cl偏移,在水分子的作用下越易电离出H+,酸性越强。
(4)分子
(5)![]() 3
3
(6)[TiCl(H2O)5]Cl2·H2O 离子键、配位键(或共价键)
【解析】试题分析:A、B、C、D、E、F、G、I均为前四周期原子序数依次增大的元素。A原子的L电子层的p能级上有一个空轨道,则A可能是C或F;C的最外层有6个运动状态不同电子,所以C是O,则A是C,B是N;D的基态原子外围电子排布式为3S2,因此D是Mg;E与D同周期,且在该周期中电负性最大,则E是Cl;F、G是同族且原子序数差2的元素,因此二者是第Ⅷ族的Fe和Ni;I的基态原子外围只有一个单电子,原子序数最大,因此I是Cu。
(1) A2H4分子和H2C2分子分别是乙烯和双氧水,则A.双氧水分子中均是单键,只有σ键,没有π键,A错误;B.乙烯分子中中心原子碳原子为sp2杂化,双氧水分子中氧原子是sp3杂化,B错误;C.双氧水是极性分子,C错误;D.原子数和价电子数分别都相等的是等电子体,二者不能互为等电子体,D错误;E.双氧水分子间存在氢键,因此乙烯分子的沸点明显低于双氧水分子的,E正确,答案选E。
(2)C、N、O三种元素中的两种,能形成原子个数比为l:3的常见微粒,该微粒是碳酸根或硝酸根,中心原子的价层电子对数均是3,且不含孤对电子,所以这两种微粒的空间构型均为平面三角形。
(3)由于HClO3中非羟基氧多,Cl正电性高,导致羟基中O的电子向Cl偏移,在水分子的作用下越易电离出H+,因而酸性越强。
(4)G与AC能形成挥发性液体Ni(CO)4,这说明熔沸点较低,因此则其固体属于分子晶体。
(5) Fe常见晶体结构为体心立方堆积,原子半径为a nm,其晶胞中含有2个铁原子,体对角线是4anm,则晶胞边长是![]() 。I常见晶体结构为面心立方堆积,原子半径为b nm,则晶胞中含有4个铜原子,面对角线是4bnm,因此晶胞边长是
。I常见晶体结构为面心立方堆积,原子半径为b nm,则晶胞中含有4个铜原子,面对角线是4bnm,因此晶胞边长是![]() ,所以两种金属的密度比为
,所以两种金属的密度比为 =
=![]() 。
。
(6) 沉淀完全后分别过滤得两份沉淀,经洗涤干燥后称量,发现原绿色晶体的水溶液得到的白色沉淀质量为原紫色晶体的水溶液得到的沉淀质量的2/3。由于氯离子能与银离子结合形成氯化银白色沉淀,因此原紫色晶体中3个氯离子均不是配体,而绿色晶体配合物中有1个氯离子是配体,因此绿色晶体配合物的化学式为[TiCl(H2O)5]Cl2·H2O,由Cl-所形成的化学键类型是配位键和离子键。


 高中必刷题系列答案
高中必刷题系列答案科目:高中化学 来源: 题型:
【题目】[化学一选修5:有机化学基础]
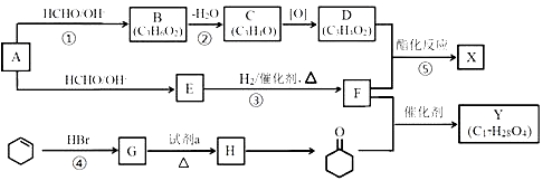
工业上可由A和环己烯(![]() )为原料合成某重要的有机物X、Y,路线如下(部分反应条件略):
)为原料合成某重要的有机物X、Y,路线如下(部分反应条件略):
已知:Ⅰ.
Ⅱ.![]()
Ⅲ.![]()
(1)B中含氧官能团的名称是___________。
(2)A的结构简式是______________。
(3)任选1种具有反式结构的C的同系物,用结构简式表示其反式结构_______。
(4)反应②、③、④、⑤中与反应①的类型相同的是_________。
(5)G→H的化学方程式是__________。
(6)E的结构构简式是________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】关于如右图所示的原电池,下列说法正确的是( )。
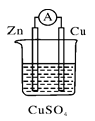
A.电流从锌电极通过电流表流向铜电极
B.锌电极发生还原反应,铜电极发生氧化反应
C.当有13 g Zn溶解时,外电路中就有0.4 mol电子通过
D.铜电极作正极,发生的电极反应为2H++2e-===H2↑
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】X、Y、Z三种元素的离子都和氩原子具有相同的电子层排布。X元素单质能在氢气中燃烧,产生苍白色火焰;Y元素氢化物的分子式是H2Y,其最高氧化物含有40%的Y;Z元素的离子具有紫色的焰色反应。
(1)根据以上条件,推断元素名称:X:_____,Y:_____,Z:________。
(2)X、Y、Z最高价氧化物对应的水化物的酸性由强到弱的顺序是________。
(3)用电子式表示Z2Y的形成过程:___________,其化合物中化学键的类型是________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】【物质与结构—选作】硼(B)、铝(Al)、镓(Ga)均属于硼族元素(第ⅢA族),它们的化合物或单质都有重要用途。回答下列问题:
(1)写出基态镓原子的电子排布式 。
(2)已知:无水氯化铝在178℃升华,它的蒸气是缔合的双分于(Al2Cl6),更高温度下Al2Cl6则离解生成A1Cl3单分子。
①固体氯化铝的晶体类型是 ;
②写出Al2Cl6分子的结构式 ;
③单分子A1Cl3的立体构型是 ,缔合双分子
Al2Cl6中Al原子的轨道杂化类型是 。
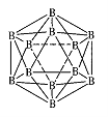
(3)晶体硼的结构单元是正二十面体,每个单元中有12个硼原子(如图),若其中有两个原子为10 B,其余为11B,则该结构单元有 种不同的结构类型。
(4)金属铝属立方晶系,其晶胞边长为405 pm,密度是2.70g·cm-3,计算确定其晶胞的类型(简单、体心或面心立方) ;晶胞中距离最近的铝原子可看作是接触的,列式计算铝的原子半径r(A1)= pm。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知铜元素能形成多种化合物。
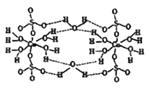
(1)写出基态Cu的M能层的电子排布式 ,Cu同周期的元素中,与铜原子最外层电子数相等的元素还有 (填元素符号)
(2)CuSO4·5H2O也可写成[Cu(H2O)4]SO4·H2O,其结构示意图如右图所示:该晶体中所含元素电负性由大到小顺序是 ,该晶体属于 晶体,该晶体中由水分子参与形成的作用力有 。
(3)Cu2+能与NH3、Cl-等形成配位数为4的配合物,已知[Cu(NH3)4]2+具有对称的空间构型,[Cu(NH3)4]2+中的两个NH3被两个Cl-取代,能得到两种不同结构的产物,则[Cu(NH3)4]2+的空间构型为 ,NH3的VSEPR 模型为 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】合成涤纶的流程图如下所示。
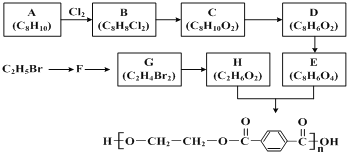
回答下列问题:
(1)B 中官能团的名称是___________________;G的名称是________________;
(2)C→D 的反应类型是________________;
(3)E与 H 反应的化学方程式为________________;
(4)下列说法正确的是_______________;
A.化合物D能发生银镜反应
B.化合物A~D均属于芳香烃
C.反应G→H属于消去反应
D.化合物D能与3molH2发生加成反应
E.化合物C、H、E均能与金属钠反应放出氢气
(5)E有多种同分异构体,符合下列条件的同分异构体有_______种,其中在核磁共振氢谱中出现四组峰的是__________________________________(写出结构简式)。
①芳香族化合物;②红外光谱显示含有羧基;③能发生银镜反应;④能发生水解反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某学生研究小组欲探究CuSO4溶液与Na2CO3溶液混合产生的蓝绿色沉淀组成,小组进行下列实验探究。
【提出假设】
假设1:沉淀为Cu(OH)2
假设2:沉淀为
假设3:沉淀为碱式碳酸铜[化学式可表示为nCuCO3mCu(OH)2]
【查阅资料】无论是哪一种沉淀受热均易分解(假设均不含结晶水)。
【物质成分探究】
步骤1:将所得悬浊液过滤,用蒸馏水洗涤,再用无水乙醇洗涤
步骤2:甲同学取一定量固体,用气密性良好的右图装置(夹持仪器未画出)进行定性实验。
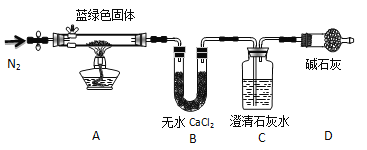
请回答下列问题:
(1)假设2中的沉淀为 。
(2)假设1中沉淀为Cu(OH)2的理论依据是 。
(3)无水乙醇洗涤的目的____ __。
(4)若反应后A中蓝绿色固体变黑,C中无明显现象,证明假设______(填写序号)成立。
(5)乙同学认为只要将上图中B装置的试剂改用 试剂后,便可验证上述所有假设。
(6)乙同学更换B试剂后验证假设3成立的实验现象是 。
(7)在假设3成立的前提下,某同学考虑用Ba(OH)2代替Ca(OH)2,测定蓝绿色固体的化学式,若所取蓝绿色固体质量为27.1g,实验结束后装置B的质量增加2.7g,C中的产生沉淀的质量为19.7g。则该蓝绿色固体的化学式为 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现有部分短周期元素的性质或原子结构如下表:
元素编号 | 元素性质或原子结构 |
T | 最外层电子数比内层电子总数少4 |
X | 最外层电子数是次外层电子数的2倍 |
Y | 与氢形成的气态化合物在标准状况下的密度为0.76g·L-1 |
Z | 元素最高正价与负价的绝对值之差是6 |
(1)元素X的一种同位素可测定文物年代,这种同位素的符号是 ,在周期表中的位置是 。
(2)元素Y与氢元素形成一种离子YH4+,写出该离子与Z离子形成化合物的电子式 。
(3)写出元素X、T形成的化合物XT2的电子式 。
(4)元素Z与元素T相比,非金属性较强的是 (用元素符号表示),下列表述中能证明这一事实的是 (填序号)。
a.常温下Z的单质和T的单质状态不同
b.Z的氢化物比T的氢化物稳定
c.一定条件下Z和T的单质都能与氢氧化钠溶液反应
d.与铁加热,Z生成三价铁,T生成二价铁
e.T原子与Z原子电子层数相同,Z原子半径小于T原子
(5)T的低价氧化物通入Z单质的水溶液中,发生反应的化学方程式为 。
(6)分别用电子式表示Z与镁元素、Y与氮元素形成化合物的过程: 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com