
分析 (1)PCl3极易水解生成亚磷酸和氯化氢时,磷元素的化合价不变,仍为+3价;
(2)反应Ⅰ中,每消耗1molCl2,反应放出211kJ的热量,根据反应I消耗了6mol氯气来分析计算;反应Ⅱ中转移1mol电子,反应放出145.7kJ的热量,而反应II转移20mol电子,据此分析计算;
(3)根据盖斯定律来分析计算;
(4)根据Cl2(g)+PCl3(g)=PCl5(g)△H=-412KJ/mol=反应物的键能-生成物的键能来计算.
解答 解:(1)PCl3极易水解生成亚磷酸和氯化氢时,磷元素的化合价不变,仍为+3价,故水解的化学方程式为:PCl3+3H2O=H3PO3+3HCl,故亚磷酸的化学式为H3PO3,故答案为:H3PO3:
(2)反应Ⅰ中,每消耗1molCl2,反应放出211kJ的热量,而反应I消耗了6mol氯气,故放出的热量为211KJ×6=1266KJ,即△H1=-1266KJ/mol;反应Ⅱ中转移1mol电子,反应放出145.7kJ的热量,而反应II转移20mol电子,故放出的热量Q=145.7KJ×20=2914KJ,即△H2=-2914KJ/mol,故答案为:-1266KJ/mol;-2914KJ/mol;
(3)由于Ⅰ.P4(s)+6Cl2═4PCl3(g)△H1=-1266KJ/mol
Ⅱ.P4(s)+10Cl2(g)═4PCl5(g)△H2=-2914KJ/mol
根据盖斯定律可知,将$\frac{II}{4}-\frac{I}{4}$可得Cl2(g)+PCl3(g)=PCl5(g)△H=-412KJ/mol,故答案为:Cl2(g)+PCl3(g)=PCl5(g)△H=-412KJ/mol;
(4)设破坏Cl2中Cl-Cl键的键能为xKJ/mol,则根据Cl2(g)+PCl3(g)=PCl5(g)△H=-412KJ/mol=反应物的键能-生成物的键能=xKJ/mol+3×326kJ•mol-1-5×326kJ•mol-1,可解得x=652KJ/mol,故破坏1molCl2中Cl-Cl键所需的能量为652KJ,故答案为:652.
点评 本题考查了反应热的有关计算以及盖斯定律的应用,难度不大,应注意的是反应热△H=反应物的键能-生成物的键能.


 鹰派教辅衔接教材河北教育出版社系列答案
鹰派教辅衔接教材河北教育出版社系列答案 初中暑期衔接系列答案
初中暑期衔接系列答案科目:高中化学 来源: 题型:多选题
| A. | 淀份与纤维素结构简式相同,互为同分异构体 | |
| B. | 聚乙烯、油脂、铜氨纤维、光导纤维都属于高分子 | |
| C. | 甲烷的二氯代物只有一种可证明甲烷为正四面体结构 | |
| D. | 蔗糖遇浓硫酸生碳化现象,但遇稀硫酸不会发生反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 在c(HCO3-)=0.1 mol•L-1的溶液中:NH4+、Al3+、Cl-、NO3- | |
| B. | 有大量NO3-存在的强酸性溶液中:NH4+、Na+、Fe3+、SO42- | |
| C. | 由水电离出的c(H+)=1×10-12mol•L-1的溶液中:Na+、Al3+、CH3COO-、I- | |
| D. | 能使pH试纸变蓝的溶液中:ClO-、S2-、Na+、K+ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 选项 | 试剂(必要时可加热 | 物质 |
| A | 硝酸银溶液 | 氯化钠溶液和碳酸钠溶液 |
| B | 氯气 | 硫酸亚铁溶液和FeCl2溶液 |
| C | MnO2 | 浓盐酸和稀硫酸 |
| D | 紫色石蕊试剂 | 次氯酸钙和次氯酸钠 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
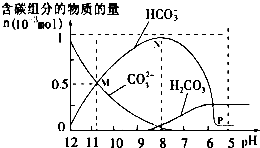 25℃时在10mL0.10mol•L-1Na2CO3溶液中逐滴加入0.10mol•L-1HCl溶液20mL,溶液中部分含碳微粒的物质的量随溶液pH的变化如图所示,下列说法正确的是( )
25℃时在10mL0.10mol•L-1Na2CO3溶液中逐滴加入0.10mol•L-1HCl溶液20mL,溶液中部分含碳微粒的物质的量随溶液pH的变化如图所示,下列说法正确的是( )| A. | pH=12的溶液中:c(Na+)=c(CO32-)+c(HCO3-)+c(H2CO3) | |
| B. | pH=7的溶液中:c(Na+)=2c(CO32-)+c(HCO3-)+c(Cl-) | |
| C. | pH=8的溶液中:c(Na+)>c(HCO3-)>c(Cl-)>c(OH-) | |
| D. | 在M点:c(Na+)>c(CO32-)=c(HCO3-)>c(OH-)>c(H+) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | n(HCl)<n(NH3•H2O) | B. | 盐酸过量 | C. | 恰好中和 | D. | 无法判断 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com