
(14分)“低碳循环”引起各国的高度重视,而如何降低大气中CO2的含量及有效地开发利用CO2,引起了全世界的普遍重视。所以“低碳经济”正成为科学家研究的主要课题
(1)用电弧法合成的储氢纳米碳管常伴有大量的碳纳米颗粒(杂质),这种颗粒可用如下氧化法提纯,请完成该反应的化学方程式:(系数按顺序填在答题卷上)
___ C+ ___ KMnO4+ ____ H2SO4 = ____CO2↑+ ____MnSO4 + ____K2SO4+ ____H2O
(2)将不同量的CO(g)和H2O(g)分别通入到体积为2L的恒容密闭容器中,进行反应
CO(g)+H2O(g)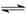 CO2(g)+H2(g),得到如下三组数据:
CO2(g)+H2(g),得到如下三组数据:
| 实验组 | 温度℃ | 起始量/mol | 平衡量/mol | 达到平衡所需时间/min | ||
| CO | H2O | H2 | CO | |||
| 1 | 650 | 4 | 2 | 1.6 | 2.4 | 6 |
| 2 | 900 | 2 | 1 | 0.4 | 1.6 | 3 |
| 3 | 900 | a | b | c | d | t |
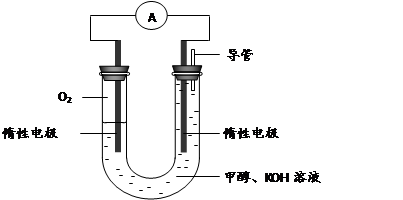
(1)5 C+ 4 KMnO4+ 6 H2SO4 = 5CO2↑+ 4MnSO4 + 2K2SO4+6H2O
(2)①0.13mol/L·min,②放,0.17
(3)①O2 + 2H2O + 4e- =4OH-
②2CH3OH + 3O2 + 4KOH = 2K2CO3 + 6H2O
(4) 5.6×10-5mol/L
解析试题分析:(1)根据氧化还原反应氧化剂、还原剂得失电子数目相等配平,反应中C元素化合价0→+4,Mn元素化合价+7→+2,反应得失电子相等,则有:5C~4KMnO4,根据质量守恒可确定H2SO4的计量数为6,则配平后的计量数分别是:5、4、6、5、4、2、6;
(2)①v(CO2)=v(CO)=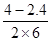 =0.13moL/(L?min);
=0.13moL/(L?min);
②实验1,达平衡时:c(H2)=0.8mol/L,c(CO2)=0.8mol/L,c(H2O)=0.2mol/L,c(CO)=1.2mol/L,则k=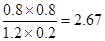
实验2,达平衡时:c(H2)=0.2mol/L,c(CO2)=0.2mol/L,c(H2O)=0.3mol/L,c(CO)=0.8mol/L,则k=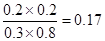
则升高温度平衡常数减小,平衡向逆反应分析移动,说明正反应放热;
(3)碱性甲醇燃料电池中,负极发生氧化反应,电极反应式为CH3OH-6e-+8OH-+=CO32-+6H2O,正极发生还原反应,电极反应式为O2+2H2O+4e-=4OH-,
则总反应式为2CH3OH+3O2+4OH-=2CO32-+6H2O;
(4)由Ksp(CaCO3)=c(CO32-)×c(Ca2+),
可知:c(CaCl2)=c(Ca2+)= mol/L,
mol/L,
考点:化学平衡常数的含义;氧化还原反应方程式的配平;热化学方程式;原电池和电解池的工作原理;难溶电解质的溶解平衡及沉淀转化的本质。
点评:本题考查较为综合,涉及化学平衡、反应热、电化学以及难溶电解质的溶解平衡等问题,题目难度较大,学习中注意相关解答方法的积累。


科目:高中化学 来源: 题型:阅读理解
 (2013?上饶一模)“低碳循环”引起各国的高度重视,而如何降低大气中CO2的含量及有效地开发利用CO2,引起了全世界的普遍重视.所以“低碳经济”正成为科学家研究的主要课题
(2013?上饶一模)“低碳循环”引起各国的高度重视,而如何降低大气中CO2的含量及有效地开发利用CO2,引起了全世界的普遍重视.所以“低碳经济”正成为科学家研究的主要课题| 实验组 | 温度℃ | 起始量/mol | 平衡量/mol | 达到平衡所需时间/min | ||
| CO | H2O | H2 | CO | |||
| 1 | 650 | 4 | 2 | 1.6 | 2.4 | 6 |
| 2 | 900 | 2 | 1 | 0.4 | 1.6 | 3 |
| 3 | 900 | a | b | c | d | t |
查看答案和解析>>
科目:高中化学 来源: 题型:
 “低碳循环”引起各国的高度重视,已知煤、甲烷等可以与水蒸气反应生成以CO和H2为主的合成气,合成气有广泛应用.试回答下列问题:
“低碳循环”引起各国的高度重视,已知煤、甲烷等可以与水蒸气反应生成以CO和H2为主的合成气,合成气有广泛应用.试回答下列问题:| c(CO2) |
| c(CO) |
| 0.025mol/L |
| 0.1mol/L |
| c(CO2) |
| c(CO) |
| 0.025mol/L |
| 0.1mol/L |
| c(CH3OH) |
| c(CO2) |
查看答案和解析>>
科目:高中化学 来源: 题型:阅读理解
| 实验组 | 温度℃ | 起始量/mol | 平衡量/mol | 达到平衡所需时间/min | ||
| CO | H2O | H2 | CO | |||
| 1 | 650 | 4 | 2 | 1.6 | 2.4 | 6 |
| 2 | 900 | 2 | 1 | 0.4 | 1.6 | 3 |
| 3 | 900 | a | b | c | d | t |
查看答案和解析>>
科目:高中化学 来源:2011-2012学年度陕西省礼泉一中高三第一学期期末考试化学试卷 题型:填空题
(16分)“低碳循环”引起各国的高度重视,而如何降低大气中CO2的含量及有效地开发利用CO2,引起了全世界的普遍重视。所以“低碳经济”正成为科学家研究的主要课题
(1)用电弧法合成的储氢纳米碳管常伴有大量的碳纳米颗粒(杂质),这种颗粒可用如下氧化法提纯,请完成该反应的化学方程式:(系数按顺序填在答题卷上)
___ C+ ___ KMnO4+ ____ H2SO4→____CO2↑+ ____MnSO4 + ____K2SO4+ ____H2O
(2)将不同量的CO(g)和H2O(g)分别通入到体积为2L的恒容密闭容器中,进行反应
CO(g)+H2O(g) CO2(g)+H2(g),得到如下三组数据:
CO2(g)+H2(g),得到如下三组数据:
| 实验组 | 温度℃ | 起始量/mol | 平衡量/mol | 达到平衡所需时间/min | ||
| CO | H2O | H2 | CO | |||
| 1 | 650 | 4 | 2 | 1.6 | 2.4 | 6 |
| 2 | 900 | 2 | 1 | 0.4 | 1.6 | 3 |
| 3 | 900 | a | b | c | d | t |

查看答案和解析>>
科目:高中化学 来源:2011届吉林省普通中学高三下学期期中教学质量检测理综化学部分 题型:填空题
“低碳循环”引起各国的高度重视,已知煤、甲烷等可以与水蒸气反应生成以CO和H2为主的合成气,合成气有广泛应用。试回答下列问题:
(1)高炉炼铁是CO气体的重要用途之一,其基本反应为:
FeO(s)+CO(g)  Fe(s)+CO2(g) ΔH >0
Fe(s)+CO2(g) ΔH >0
已知在1100℃时,该反应的化学平衡常数K=0.263。
①温度升高,化学平衡移动后达到新的平衡,此时平衡常数K值__________(填“增大”、“减小”或“不变”);
②1100℃时测得高炉中,c(CO2)=0.025mol·L-1,c(CO)="0.1" mol·L-1,则在这种情况下,该反应向_______进行(填“左”或“右”),判断依据是
。
(2)一氧化碳与氢气反应生成甲醇(催化剂为Cu2O/ZnO)。
已知:2CO(g) + O2(g)=2CO2(g) ΔH =–566 kJ·mol―1
2H2O(g) =2H2(g) + O2(g) ΔH =+484 kJ·mol―1
CH3OH(g) + 1/2O2(g)=CO2(g) + 2H2(g) ΔH =–192.9 kJ·mol―1
请写出CO与H2在一定条件下反应生成CH3OH(g)的热化学方程式
。
(3)目前工业上也可用CO2来生产燃料甲醇,有关反应为:CO2(g)+3H2(g) CH3OH(g)+H2O(g) ΔH =-49.0 kJ·mol-1,现向体积为1 L的密闭 容器中,充入1mol CO2和3mo
CH3OH(g)+H2O(g) ΔH =-49.0 kJ·mol-1,现向体积为1 L的密闭 容器中,充入1mol CO2和3mo l H2,反应过程中测得CO2和CH3OH(g)的浓度随时间的变化如图所示。
l H2,反应过程中测得CO2和CH3OH(g)的浓度随时间的变化如图所示。
①从反应开始到平衡,氢气的平均反应速率v(H2)=_______ _;
②反应达到平衡后,下列措施能使 增大的是______(填符号)。
增大的是______(填符号)。
| A.升高温度 | B.再充入H2 | C.再充入CO2 |
| D.将H2O(g)从体系中分离 E.充入He(g) |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com