
【题目】某化学兴趣小组制取氯酸钾和氯水并进行有关探究实验。
实验一:制取氯酸钾和氯水
利用如图所示的实验装置进行实验。
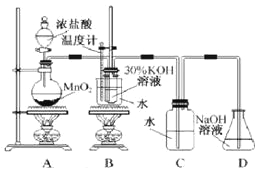
(1)制取实验结束后,取出B中试管冷却结晶、过滤、洗涤。该实验操作过程需要的玻璃仪器有__。
(2)若对调B和C装置的位置,__(填“能”或“不能”)提高B中氯酸钾的产率。
实验二:氯酸钾与碘化钾反应的探究
(3)在不同条件下KClO3可将KI氧化为I2或KIO3。该小组设计了系列实验研究反应条件对反应产物的影响,其中系列a实验的记录表如下(实验在室温下进行):
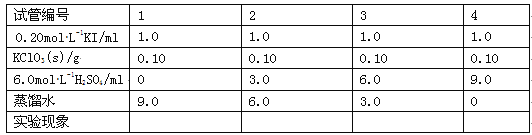
①系列a实验的实验目的是__。
②设计1号试管实验的作用是__。
③若2号试管实验现象为“黄色溶液”,取少量该溶液加入淀粉溶液显蓝色;假设氧化产物唯一,还原产物为KCl,则此反应的离子方程式为__。
实验三:测定饱和氯水中氯元素的总量
(4)该小组设计的实验方案为:使用如图装置,加热15.0ml饱和氯水试样,测定产生气体的体积。此方案不可行的主要原因是__。(不考虑实验装置及操作失误导致不可行的原因)
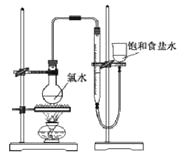
(5)根据下列资料,为该小组设计一个可行的实验方案(不必描述操作过程的细节):__。
资料:i.次氯酸会破坏酸碱指示剂;
ii.次氯酸或氯水可被SO2、H2O2、FeCl2等物质还原成Cl-。
【答案】烧杯、漏斗、玻璃棒、胶头滴管 能 研究反应体系中硫酸浓度对反应产物的影响 硫酸浓度为0的对照实验 ClO3-+6I-+6H+=Cl-+3I2+3H2O 因存在Cl2的重新溶解、HClO分解等,此方案无法测算试样含氯总量 量取一定量的试样,加入足量的H2O2溶液,加热除去过量的H2O2,冷却,再加入足量的硝酸银溶液,称量沉淀质量
【解析】
实验一:A为制备氯气的装置,B为氯气与氢氧化钾在加热条件下生成氯酸钾的装置,D为尾气吸收氯气的装置。
实验二:KClO3具有强氧化性,可将KI氧化为I2或KIO3。四组实验在相同的温度下进行,氯酸钾和碘化钾的浓度也分别相同,通过实验来研究不同硫酸的浓度对反应速率的影响。
(1)过滤和洗涤需要用到的玻璃仪器有烧杯、漏斗、玻璃棒,胶头滴管,故答案为:烧杯、漏斗、玻璃棒、胶头滴管;
(2)对调B和C装置的位置,C可以除去氯气中混有的HCl气体,避免氢氧化钾与氯化氢气体发生酸碱中和反应而被消耗,从而能提高B中氯酸钾的产率,故答案为:能;
(3)①由分析可知,系列a实验的实验目的是研究反应体系中硫酸浓度对反应产物的影响,故答案为:研究反应体系中硫酸浓度对反应产物的影响;
②1号试管实验中硫酸的浓度为0,即不加硫酸,为对照实验,故答案为:硫酸浓度为0的对照实验;
③2号试管实验现象说明产物为碘单质,则氯酸钾与碘化钾反应生成氯化钾和碘单质,其反应的离子方程式为ClO3-+6I-+6H+=Cl-+3I2+3H2O,故答案为:ClO3-+6I-+6H+=Cl-+3I2+3H2O;
(4)加热饱和氯水制备氯气,生成的氯气能重新溶解,且氯水中次氯酸能发生分解生成氯化氢和氧气等,则此方案无法测算试样含氯总量,故答案为:因存在Cl2的重新溶解、HClO分解等,此方案无法测算试样含氯总量;
(5)根据资料ii可知次氯酸或氯水可被SO2、H2O2、FeCl2等物质还原成Cl-,然后利用银离子能与氯离子结合生成氯化银沉淀,通过测定氯化银沉淀的质量,最后可计算出氯元素的总质量,其中一种方案为:量取一定量的试样,加入足量的H2O2溶液,加热除去过量的H2O2,冷却,再加入足量的硝酸银溶液,称量沉淀质量,故答案为:量取一定量的试样,加入足量的H2O2溶液,加热除去过量的H2O2,冷却,再加入足量的硝酸银溶液,称量沉淀质量。


 考前必练系列答案
考前必练系列答案科目:高中化学 来源: 题型:
【题目】铝是应用广泛的金属。以铝土矿 (主要成分为Al2O3,含SiO2和Fe2O3等杂质)为原料制备铝的一种工艺流程如图:

注:SiO2在“碱溶”时转化为铝硅酸钠沉淀。
(1)Al的原子结构示意图为_________;Al与NaOH溶液反应的离子方程式为________。
(2)“碱溶”时生成偏铝酸钠的离子方程式为_______________。
(3)“电解Ⅰ”是电解熔融Al2O3,电解过程中作阳极的石墨易消耗,原因是___________。
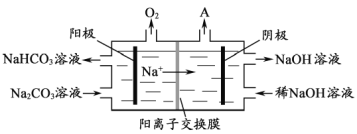
(4)“电解Ⅱ”是电解Na2CO3溶液,原理如图所示。阳极的电极反应式为_________,阴极产生的物质A的化学式为____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】K2Cr2O7溶液中存在平衡:Cr2O72-(橙色)+H2O2CrO42-(黄色)+2H+。用K2Cr2O7溶液进行下列实验:
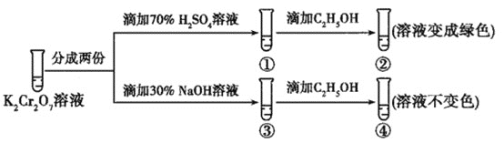
结合实验,下列说法不正确的是( )
A.①中溶液橙色加深,③中溶液变黄
B.②中Cr2O72-被C2H5OH还原
C.对比②和④可知K2Cr2O7酸性溶液氧化性强
D.若向④中加入70%H2SO4溶液至过量,溶液变为橙色
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】商代炼铜时,所用的矿物原料主要是孔雀石,主要燃料是木炭,在温度1000℃左右冶炼,可能涉及的反应有:
①Cu2(OH)2CO3![]() 2CuO+CO2↑+H2O;
2CuO+CO2↑+H2O;
②2CuO+C![]() 2Cu+CO2↑;
2Cu+CO2↑;
③CuO+CO![]() Cu+CO2;
Cu+CO2;
④CO2+C![]() 2CO。
2CO。
(1)从四种基本反应类型来看,①②④的反应类型分别为①___________,②___________,④___________。
(2)反应③中,____________发生氧化反应,__________发生还原反应。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】填空题。
(1)47.5g某二价金属的氯化物中含有1molCl-,则该金属氯化物的摩尔质量为_______ ;该金属的相对原子质量为_______ 。
(2)标准状况下,3.4g NH3 的体积为_______ ;它与标准状况下_______ L H2S含有相同数目的氢原子。
(3)已知CO、CO2混合气体的质量共10.0g,在标准状况下的体积为6.72L,则混合气体中CO的质量为_______ ;CO2在相同状况下的体积为_______ 。
(4)将4g NaOH 溶解在10mL水中,再稀释成1L,从中取出10mL,这10mL溶液的物质 的量浓度为_______。
(5)已知ag氢气中含有b个氢原子,则阿伏加德罗常数的值可表示为 _______ 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】
(1)某液体化合物X2Y4,常用做火箭燃料。16g X2Y4在一定量的O2中恰好完全燃烧,反应方程式为X2Y4(l)+O2(g)==X2(g)+2Y2O(l)。冷却后标准状况下测得生成物的体积为11.2 L,其密度为1.25 g·L-1,则:
①反应前O2的体积V(O2)为________。
②X2的摩尔质量为________________。
③Y元素的名称是________________。
(2)取1.43 g Na2CO3·xH2O溶于水配成50mL溶液,然后逐滴滴入稀盐酸直至没有气体放出为止,共消耗盐酸20.0mL,并收集到112mLCO2(标准状况下)。
①稀盐酸物质的量浓度为________________mol·L-1
②Na2CO3·xH2O的摩尔质量为__________ g·mol-1
③x=________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图为实验室某浓盐酸试剂瓶标签上的有关数据,试根据标签上的有关数据回答下列问题:
盐酸
分子式:HCl
相对分子质量:36.5
密度:1.19g/cm3
质量分数:36.5%
(1)该浓盐酸中HCl的物质的量浓度为______molL-1。
(2)某学生欲用上述浓盐酸和蒸馏水配480mL物质的量浓度为0.200molL-1的稀盐酸。
①配制稀盐酸时,应选用容量瓶的规格是_______mL。
②该学生需要用取___mL上述浓盐酸进行配制。
③若出现如下情况,对所配溶液浓度将有何影响?(填“偏高”、“偏低”或“无影响”)
量取浓盐酸时俯视刻度线_____,定容时仰视刻度线_____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某溶液X中可能含有Na+、Fe3+、Mg2+、HCO3-、Cl-、SO42-、SO32-中的若干种,所含离子的物质的量浓度均相同,为了确定该溶液的组成,某同学取100mL上述溶液X,进行如下实验:
![]()
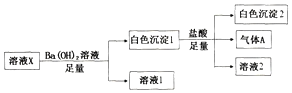
下列说法正确的是
A. 气体A可能是CO2或SO2
B. 溶液X中一定存在Na+、Mg2+、HCO3-、SO42-
C. 溶液X中一定不存在Fe3+和Mg2+,可能存在-Na+
D. 分别在溶液1和溶液2中加入硝酸酸化的硝酸银溶液都能生成白色沉淀
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列变化中,气体被还原的是
A.水蒸气使 CuSO4固体变蓝B.氯气使浅绿色 FeC12 溶液变黄
C.H2使灼热CuO 固体变红D.氨气使A1Cl3溶液产生白色沉淀
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com