
【题目】按要求回答有关问题:
(1)H2S与CO2在高温下发生反应:H2S(g)+CO2(g)![]() COS(g) +H2O(g)。在610 K时,将0.10 mol CO2与0.40 mol H2S充入2.5 L的空钢瓶中,反应平衡后水的物质的量分数为0.02。则H2S的平衡转化率为______%,反应平衡常数K=________。
COS(g) +H2O(g)。在610 K时,将0.10 mol CO2与0.40 mol H2S充入2.5 L的空钢瓶中,反应平衡后水的物质的量分数为0.02。则H2S的平衡转化率为______%,反应平衡常数K=________。
(2)已知25℃,NH3·H2O的Kb=1.8×105,H2SO3的Ka1=1.3×102,Ka2=6.2×108。若氨水的浓度为2.0 mol·L1,溶液中的c(OH)=_________________ mol·L1。将SO2通入该氨水中,当c(OH)降至1.0×107 mol·L1时,溶液中的c(![]() )/c(
)/c(![]() )=___________________。
)=___________________。
(3)在化学分析中采用K2CrO4为指示剂,以AgNO3标准溶液滴定溶液中Cl,利用Ag+与CrO42生成砖红色沉淀,指示到达滴定终点。当溶液中Cl恰好沉淀完全(浓度等于1.0×105 mol·L1)时,溶液中c(Ag+)为_______ mol·L1,此时溶液中c(CrO42)等于__________ mol·L1。(已知Ag2CrO4、AgCl的Ksp分别为2.0×1012和2.0×1010)。
【答案】 2.5 2.8×10-3 6×10-3 0.62 2.0×10-5 5×10-3
【解析】(1)在610 K时,将0.10 mol CO2与0.40 mol H2S充入2.5 L的空钢瓶中,反应达到平衡后H2O的物质的量分数为0.02,设转化得到COS为x,则
H2S(g)+CO2(g)![]() COS(g) +H2O(g)
COS(g) +H2O(g)
开始(mol) 0.4 0.1 0 0
转化(mol) x x x x
平衡(mol) 0.4-x 0.1-x x x
![]() =2%,解得x=0.01mol,H2S的平衡转化率=
=2%,解得x=0.01mol,H2S的平衡转化率=![]() ×100%=2.5%,反应平衡常数K=
×100%=2.5%,反应平衡常数K=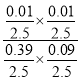 =2.8×10-3,故答案为:2.5;2.8×10-3;
=2.8×10-3,故答案为:2.5;2.8×10-3;
(2)NH3H2O的Kb=1.8×10-5,若氨水的浓度为2.0molL-1,由Kb=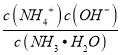 可知c(OH-)=
可知c(OH-)=![]() mol/L=6.0×10-3mol/L,当c(OH-)降至1.0×10-7 molL-1时,c(H+)=1.0×10-7 molL-1,H2SO3的Ka2=6.2×10-8,由Ka2=
mol/L=6.0×10-3mol/L,当c(OH-)降至1.0×10-7 molL-1时,c(H+)=1.0×10-7 molL-1,H2SO3的Ka2=6.2×10-8,由Ka2=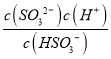 可知c(SO32-)/c(HSO3-)=
可知c(SO32-)/c(HSO3-)=![]() =0.62,故答案为:6.0×10-3;0.62;
=0.62,故答案为:6.0×10-3;0.62;
(3)当溶液中Cl-完全沉淀时,即c(Cl-)=1.0×10-5mol/L,依据Ksp(AgCl)=2.0×10-10,计算得到c(Ag+)=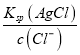 =
=![]() =2.0×10-5mol/L,此时溶液中c(CrO42-)=
=2.0×10-5mol/L,此时溶液中c(CrO42-)=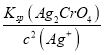 =
= =5.0×10-3mol/L,故答案为:2.0×10-5 ;5.0×10-3。
=5.0×10-3mol/L,故答案为:2.0×10-5 ;5.0×10-3。


科目:高中化学 来源: 题型:
【题目】某金属A及其化合物之间有如下的转化关系: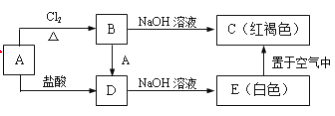
(1)写出A、B的化学式:A_______,B_________。
(2)写出B→D的化学方程式_______________________________。
(3)写出B→C的离子方程式________________________________。
(4)写出E→C的化学方程式________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某工厂废水中含游离态氯,通过下列实验测定其浓度。
①取水样10.0mL于锥形瓶中,加入10.0mL的KI溶液(足量),发生的反应为:Cl2+2KI=2KC1+I2,滴入指示剂2~3滴。
②取碱式滴定管依次用自来水、蒸馏水洗净后,马上注入0.01mol/LNa2S2O3溶液,调整液面,记下读数。
③将锥形瓶置于滴定管下进行滴定,发生的反应为:I2+2Na2S2O3=2NaI+2Na2S4O6.试回答下列问题:
(1)步骤①加入的指示剂是____________。
(2)判断达到滴定终点的实验现象是____________。
(3)假设未描述的事项都规范合理,则该测定结果将_______(填“偏高”、“偏低”或“无影响”)。
(4)碳酸H2CO3,K1=4.3×10-7,K2=5.6×10-11,草酸H2C2O4,K1=5.9X10-2,K2=6.4×10-5。0.1mol/LNa2CO3溶液的pH____0.1mol/L Na2C2O4溶液的pH。(选填“大于”、“小于”或“等于”)。若将等浓度的草酸溶液和碳酸溶液等体积混合,溶液中各种离子浓度大小的顺序正确的是________。(选填编号)
A. c(H+)>c(HC2O4-)>c(HCO3-)>c(CO32-) B. c(HCO3-)>c(HC2O4-)>c(C2O42-)>c(CO32-)
C. c(H+)>c(HC2O4-)>c(C2O42-)>c(CO32-) D. c(H2CO3)>c(HCO3-)>c(HC2O4-)>c(CO32-)
(5) 已知: ①难溶电解质的溶度积常数: Ksp(CaF2)=1.5×10-10②25℃时,2.0×10-3mol/L氢氟酸水溶液中,调节溶液pH (忽略体积变化),得到c(HF)、c(F-)与溶液pH的变化关系,如下图所示,请根据以下信息回答下列问题:

①25℃时,HF电离平衡常数的数值Ka≈________。
②4.0×10-3mo1/LHF溶液与4.0×10-4mo1/L CaCl2液等体积混合,调节混合液pH为4.0(忽略调节混合液体积的变化),请通过列式计算说明是否有沉淀产生:_______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关实验操作、实验现象和所得结论均正确的是
实验操作 | 实验现象 | 结论 | |
A | 在2mL5%的H2O2溶液中加入1mL饱和FeCl3溶液 | 产生大量气泡 | Fe3+能催化H2O2的分解 |
B | 用0.100molL-1盐酸滴定未知浓度NaOH溶液(甲基橙做指示剂) | 溶液由橙色变红色,且在半分钟内不恢复 | 滴定到达终点 |
C | 向浓度均为0.1 mol·L-1NaCl 和NaI 混合溶液中滴加少量AgNO3溶液 | 产生黄色沉淀 | 溶度积: Ksp(AgCl)<Ksp(AgI) |
D | 往加有酚酞的碳酸钠溶液中加入足量的CaCl2溶液 | 产生白色沉淀,红色褪去 | 证明CO32-水解呈碱性 |
A. A B. B C. C D. D
查看答案和解析>>
科目:高中化学 来源: 题型:
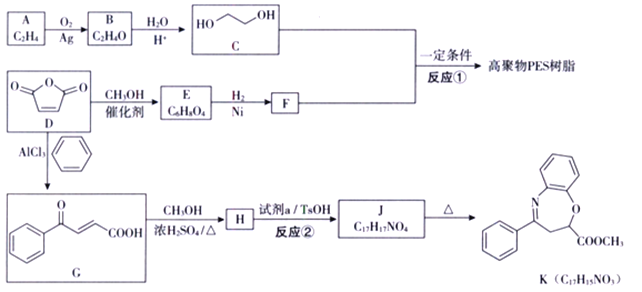
【题目】![]() 是一种重要的化工原料,可用于合成可降解的高聚物PES树脂以及具有抗肿瘤活性的化合物K。
是一种重要的化工原料,可用于合成可降解的高聚物PES树脂以及具有抗肿瘤活性的化合物K。
已知:i.R1CO18OR2+R3OH![]() R1COOR3+R218OH
R1COOR3+R218OH
ii. 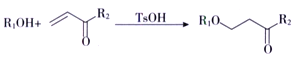
ⅲ.  (R1、R2、R3代表烃基)
(R1、R2、R3代表烃基)
(1)A的名称是_________;C的官能团的名称是_________。
(2)B分子为环状结构,核磁共振氢谱只有一组峰,B的结构简式为_________ .
(3)E分子中含有两个酯基,且为顺式结构,E的结构简式为_________ .
(4)反应①的化学方程式为_________ 。
(5)试剂a的结构简式为_________;反应②所属的反应类型为________反应。
(6)已知:  。以1,3-丁二烯为起始原料,结合已知信息选用必要的无机试剂合成
。以1,3-丁二烯为起始原料,结合已知信息选用必要的无机试剂合成![]() 。将以下合成路线补充完整:_________________
。将以下合成路线补充完整:_________________

(7)已知氨基(-NH2)与羟基类似,也能发生反应i。在由J制备K的过程中,常会产生副产物L。L分子式为C16H13NO3,含三个六元环,则L的结构简式为________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氢能是发展中的新能源,它的利用包括氢的制备、储存和应用三个环节。回答下列问题:
(1)已知氢气在氧气中燃烧生成3.6g液态水放热57.16kJ的热量,请写出表示氢气燃烧热的热化学方程式___________________________;若断开H2(g)中1molH-H需要吸收436kJ的能量,生成H2O(g)中的1mol H-O键放出463 kJ的能量,18g液态水转化为水蒸气需要吸收44 kJ的能量,则断开1molO2中的共价键需要吸收___________kJ的能量。
(2)氢气直接燃烧的能量转换率远低于燃料电池,写出碱性氢氧燃料电池的正极反应式:___
(3)利用太阳能直接分解水制氢,是最具吸引力的制氢途径,其能量转化形式为_______
(4)在恒温恒容的密闭容器中,某储氢反应:MHx(s)+yH2(g)![]() MHx+2y(s) ΔH<0达到化学平衡。下列有关叙述正确的是________
MHx+2y(s) ΔH<0达到化学平衡。下列有关叙述正确的是________
a.容器内气体压强保持不变
b. 1 mol MHx能够吸收ymol H2
c.若降温,该反应的平衡常数增大
d.若向容器内通入少量氢气,则c(H2)增大
(5)化工生产的副产氢也是氢气的来源。电解法制取有广泛用途的Na2FeO4,同时获得氢气:Fe+2H2O+2OH![]() FeO42+3H2↑,工作原理如图1所示。装置通电后,铁电极附近生成紫红色的FeO42,镍电极有气泡产生。若氢氧化钠溶液浓度过高,铁电极区会产生红褐色物质。已知:Na2FeO4只在强碱性条件下稳定,易被H2还原。
FeO42+3H2↑,工作原理如图1所示。装置通电后,铁电极附近生成紫红色的FeO42,镍电极有气泡产生。若氢氧化钠溶液浓度过高,铁电极区会产生红褐色物质。已知:Na2FeO4只在强碱性条件下稳定,易被H2还原。
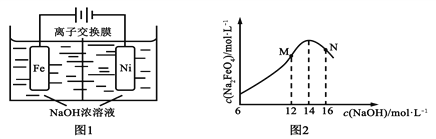
①请写出阳极电极反应式________________________
②电解过程中,须将阴极产生的气体及时排出,其原因是______________________
③c( Na2FeO4)随初始c(NaOH)的变化如图2,请分析在实验中控制NaOH浓度为14mol/L的原因:______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】高铁酸盐在水溶液中有四种含铁型体,25℃时,它们的物质的量分数随pH的变化如图所示。下列叙述错误的是
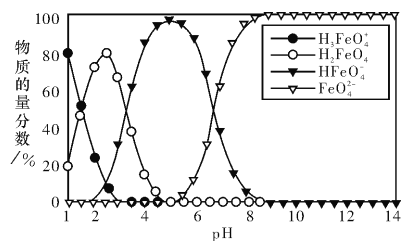
A. 已知H3FeO4+的电离半衡常数分别为:K1=2.5×10-2,K2=4.8×10-4,K3=5.0×10-8,当pII=4吋,溶液中![]()
B. 为获得尽可能纯净的高铁酸盐,应控制pH≥9
C. 向pH=5的高铁酸盐溶液中加入KOH溶液,发生反应的离子方程式为HFeO4ˉ+OHˉ=FeO42-+H2O
D. pH=2时,溶液中主要含铁型体浓度的大小关系为c(H2FeO4)>c(H3FeO4+)> c (HFeO4ˉ)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将N2、H2的混合气体分别充入甲、乙、丙三个容器中,进行合成氨反应,经过相同的一段时间后,测得反应速率分别为:甲:v(H2)=3 mol·L-1·min-1;
乙:v(N2)=2 mol·L-1·min-1;丙:v(NH3)= 1 mol·L-1·min-1。
则三个容器中合成氨的反应速率( )
A. v(甲)>v(乙)>v(丙) B. v(乙)>v(丙)>v(甲)
C. v(丙)>v(甲)>v(乙) D. v(乙)>v(甲)>v(丙)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】—定条件下,在容积为10L的密闭容器中,将2molX和1molY进行如下反应:2X(g)+Y(g)![]() Z(s),经1min达到平衡生成0.3mol的Z,下列说法正确的是
Z(s),经1min达到平衡生成0.3mol的Z,下列说法正确的是
A. 1min内,用Z表示平均反应速率为0.03mol·L-1·min-1
B. 将容器容积变为20L,Z的新平衡浓度将等于原平衡浓度的一半
C. 当X的体积分数不变时,则说明该反应达到平衡状态
D. 若温度和体积不变,往容器内增加1molX,Y的转化率将增大
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com