
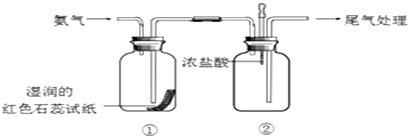
分析 (1)实验室用加热氯化铵和氢氧化钙混合物的方法制取氨气;
(2)氨气易溶于水,氨水显碱性;
(3)氨气与氯化氢反应;
(4)根据氨气的性质分析;
(5)因为氨气极易溶于水,所以可以用水吸收过量氨气,但是吸收氨气时要用防倒吸装置.
解答 解:(1)在加热条件下,氯化铵和氢氧化钙反应生成氯化钙、氨气和水,反应方程式为:2NH4Cl+Ca(OH)2$\frac{\underline{\;\;△\;\;}}{\;}$2NH3↑+CaCl2+2H2O,
故答案为:2NH4Cl+Ca(OH)2$\frac{\underline{\;\;△\;\;}}{\;}$2NH3↑+CaCl2+2H2O;
(2)氨气极易溶于水,氨气和水反应生成一水合氨,一水合氨电离出氢氧根离子和铵根离子而使溶液呈碱性,无色酚酞试液遇碱变红色,
故答案为:a;
(3)向②中滴入浓盐酸,生成氯化铵固体,有白烟生成;
故答案为:有白烟生成;
(4)①、②中的现象说明氨气能与H2O、HCl反应,分别生成一水合氨、氯化铵,故答案为:H2O、HCl;
(5)因为氨气极易溶于水,所以可以用水吸收过量氨气,但是吸收氨气时要用防倒吸装置,所以尾气的处理方法是用倒扣的小漏斗通入水中,
故答案为:用倒扣的小漏斗通入水中.
点评 本题考查了氨气的制备及氨气的性质,题目难度中等,掌握物质性质和实验基本操作是解题关键,注意积累实验室中常用的防倒吸装置.


科目:高中化学 来源: 题型:选择题
| A. | 上述反应中氧化产物只有N2 | |
| B. | 经测定,NaCN的水溶液呈碱性,说明CN-能促进水的电离 | |
| C. | 若上述反应生成0.4molCO2,则溶液中阴离子增加的物质的量为2mol | |
| D. | 现取1L含CN-1.04mg/L的废水,理论需用4.010-5molCl2处理 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 下面关于图所示实验装置的使用方法中叙述正确的是( )
下面关于图所示实验装置的使用方法中叙述正确的是( )| A. | 全正确 | B. | ②③④⑤ | C. | ①③④⑤ | D. | ①②③④ |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
 物质结构决定物质性质.回答下列问题:
物质结构决定物质性质.回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①、② | B. | ①、④ | C. | ①、③ | D. | ②、④ |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①⑤⑥⑦ | B. | ①③④⑦⑧ | C. | ②③④⑤⑥⑦ | D. | ①②③④⑤⑥⑦ |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 29:8:13 | B. | 22:1:14 | C. | 13:8:13 | D. | 26:16:13 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com