
分析 (1)若原溶液呈明显的酸性,则和氢离子反应的离子不能大量共存,金属铝和硝酸之间反应得到的气体是NO,不是氢气;
(2)原溶液呈明显的碱性,则和氢氧根离子反应的离子不能大量共存,根据溶液中一定符合电荷守恒以及离子之间的反应知识回答.
解答 解:(1)若原溶液呈明显的酸性,则和氢离子反应的离子:OH-、SO32-、CO32-不能大量共存,它能与铝作用,且生成的气体中只有氢气,所以NO3-不能存在,溶液中可能大量存在的离子有:Ba2+、Mg2+、Cl-;故答案为:Ba2+、Mg2+、Cl-;
(2)原溶液呈明显的碱性,则一定含有氢氧根离子,和氢氧根离子反应的离子:H+、Mg2+,不能大量共存,一定存在阳离子Ba2+,一定不存在SO32-、CO32-,所以可能大量存在的离子有Ba2+、Cl-、NO3-.
故答案为:Ba2+、Cl-、NO3-.
点评 本题考查离子的检验和共存知识,明确习题中的信息及离子之间的反应即可解答,题目难度不大,注意⑤为学生解答的难点和易错点.


 ABC考王全优卷系列答案
ABC考王全优卷系列答案科目:高中化学 来源: 题型:解答题
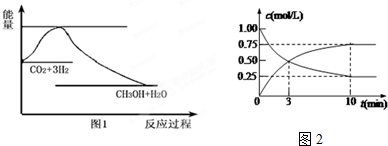
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | CaCO3+2HCl═CaCl2+H2O+CO2↑ | B. | Fe+2HCl═FeCl2+H2↑ | ||
| C. | MnO2+4HCl (浓)═MnCl2+Cl2↑+2H2O | D. | NaOH+HCl═NaCl+H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
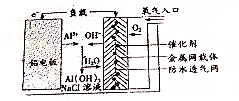
| A. | 电池的负极材料为附着有催化剂的金属网载体 | |
| B. | 电池负极的电极反应为2Cl-2e-═Cl2↑ | |
| C. | 铝电池的电极反应为Al-3e-═Al3+ | |
| D. | 正极的电极反应为O2+4H++4e-═2H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 100mL0.1mol•L-1FeCl3溶液中含有Fe3+的数目为0.01NA | |
| B. | 在铜与单质硫的反应中,1mol铜失去的电子数为2NA | |
| C. | 15.6g由Na2S和Na2O2组成的固体混合物中,含有的阴离子数为0.2NA | |
| D. | 104g苯乙烯(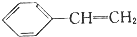 )中含有碳氢键的数目和碳碳双键的数目分别为8NA和4NA )中含有碳氢键的数目和碳碳双键的数目分别为8NA和4NA |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com