
 | K | L | M | N | 选项 |
| 19 | 2 | 8 | 9 | A | |
| 22 | 2 | 8 | 8 | 4 | B |
| 30 | 2 | 8 | 18 | 2 | C |
| 33 | 2 | 8 | 20 | 3 | D |
| A. | A | B. | B | C. | C | D. | D |
分析 A.最外层电子不超过8个,K为最外层不超过2个;
B.先填充4s轨道,再填充3d轨道;
C.符合电子排布规律;
D.M层最多容纳18个电子.
解答 解:A.最外层电子不超过8个,K为最外层不超过2个,M层为最外层排了9个电子,不符合电子排布规律,故A错误;
B.先填充4s轨道,再填充3d轨道,即N层中的4s轨道填充2个电子后,继续填充3d轨道,则M层为10个电子,N层为2个电子,故B错误;
C.K、L、M、N的电子排布分别为2、8、18、2符合电子排布规律,故C正确;
D.M层最多容纳18个电子,D选项中M层排有20个电子,不符合电子排布规律,故D错误.
故选C.
点评 本题考查了核外电子排布规律,题目难度不大,注意把握每个电子层最多能容纳的电子数、以及能级交错引起的电子排布的特殊性.


科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 溴乙烷是一种重要的有机化工原料,其沸点为38.4℃.制备溴乙烷的一种方法是乙醇与氢溴酸反应.
溴乙烷是一种重要的有机化工原料,其沸点为38.4℃.制备溴乙烷的一种方法是乙醇与氢溴酸反应.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
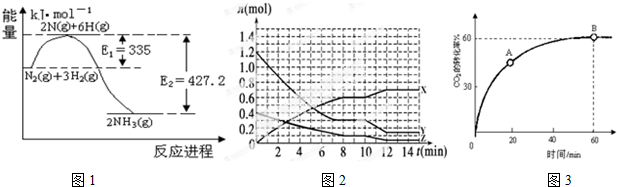
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
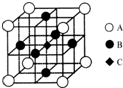 信息一:铬同镍、钴、铁等金属可以构成高温合金、电热合金、精密合金等,用于航空、宇航、电器及仪表等工业部门.
信息一:铬同镍、钴、铁等金属可以构成高温合金、电热合金、精密合金等,用于航空、宇航、电器及仪表等工业部门.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 漂白粉、胆矾都是混合物 | |
| B. | 烧碱、纯碱都是离子化合物 | |
| C. | 二氧化碳、二氧化氮都是酸性氧化物 | |
| D. | 水、氨水都是弱电解质 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ②⑤ | B. | ③⑤ | C. | ②④ | D. | ①④ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com