

| 物质 | VOSO4 | V2O5 | NH4VO3 | (VO2)2SO4 |
| 溶解性 | 可溶 | 难溶 | 难溶 | 易溶 |
分析 废钒催化剂粉碎、水浸,将溶解性物质溶于水,然后过滤得到滤渣和滤液,根据溶解性表知,滤液中含有VOSO4,滤渣中含有V2O5等不溶性杂质,向滤渣中加入亚硫酸钠和稀硫酸,亚硫酸钠具有还原性,能将V2O5还原为VOSO4,然后过滤得到滤渣和滤液,将两部分滤液混合并加入氯酸钾,氯酸钾具有氧化性,能将VOSO4氧化为(VO2)2SO4,调节溶液pH为8且采用离子交换方法得到VO3-,向溶液中加入氯化铵,得到难溶性的NH4VO3,焙烧NH4VO3得到V2O5,
(1)铝热反应实质是置换反应,铝与五氧化二钒反应生成钒与氧化铝;
(2)根据废钒催化剂的组成及表中数据判断滤液主要成分;
(3)依据流程中的沉淀分离书写离子方程式;根据题中图象分析坐标系中表示的含义,结合图中的沉矾率与沉淀温度关系选择最佳温度,再根据沉矾率与氯化铵系数选择最佳的氯化铵系数;
(4)离子方程式中一定满足质量守恒和电荷守恒,先根据电荷守恒计算出n,再根据氢原子质量守恒计算出m.
解答 解:(1)铝与五氧化二钒反应生成钒与氧化铝,反应方程式为3V2O5+10Al $\frac{\underline{\;高温\;}}{\;}$6V+5Al2O3,
故答案为:3V2O5+10Al $\frac{\underline{\;高温\;}}{\;}$6V+5Al2O3;
(2)废钒催化剂中含有V2O5、VOSO4及不溶性残渣,由于V2O5为难溶物,所以滤液中含钒的主要成分为VOSO4,
故答案为:VOSO4 ;
(3)根据NH4VO3难溶于水,利用复分解反应沉淀VO3-,离子方程式为:NH4++VO3-=NH4VO3↓,
根据沉钒率与沉淀温度的图象可知,在80℃时沉矾率最高为98%,再根据氯化铵系数与沉钒率可知,氯化铵系数为4时沉钒率最高,所以最佳控制氯化铵系数和温度分别为:4,80℃,
故答案为:NH4++VO3-=NH4VO3↓; 4;80;
(4)2VO2++H2C2O4+2H+═2VOn++2CO2↑+mH2O,根据电荷守恒,2n=1×2+1×2,解得n=2;再根据氢原子质量守恒看得:2+2=2m,则m=2,
故答案为:2;2.
点评 本题考查了铝热反应、氧化还原反应、离子反应等知识,题目难度中等,正确分析、理解工业流程是解题关键,注意明确铝热反应原理及电荷守恒、质量守恒在配平反应方程式中的应用.


 小学生10分钟口算测试100分系列答案
小学生10分钟口算测试100分系列答案科目:高中化学 来源: 题型:实验题
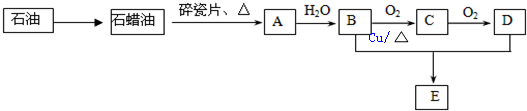
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 配位体是Cl-和NH3,配位数是8 | |
| B. | 中心离子是Co2+,配离子是Cl- | |
| C. | 内界和外界中的Cl的数目比是1:2 | |
| D. | 加入足量AgNO3溶液,所有Cl-一定被完全沉淀 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
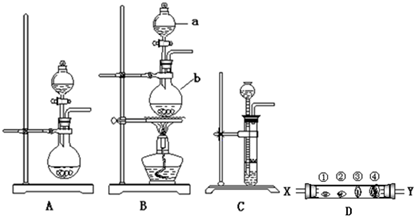
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 操作 | 现象或结果 |
| I.取m g 铁粉,在水蒸气中加热一段时间 | 灰黑色铁粉变成黑色 |
| II.用排水集气法收集一小试管气体,移近到燃着 的酒精灯火焰 | 发出爆鸣声 |
| III.将黑色固体干燥、称量 | 得到n g 黑色固体 |
| IV.将黑色固体加入到过量的盐酸中 | 固体溶解,有少量气体生成,得到黄色溶液 |
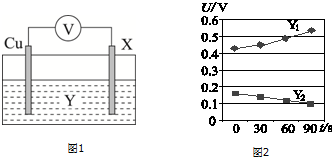
| X | U/V |
| 纯铁片 | 0.91 |
| 表面有磁性氧化铁膜的铁片 | U1 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①③④ | B. | ③⑤⑥ | C. | ②③⑥ | D. | ③④⑤ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 ,下列说法中不正确的是( )
,下列说法中不正确的是( )| A. | 该有机物属于饱和烷烃 | |
| B. | 该烃与2,5-二甲基-3-乙基己烷互为同系物 | |
| C. | 该烃的名称是3-甲基-5-乙基庚烷 | |
| D. | 该烃的一氯取代产物共有8种 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 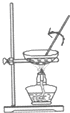 图:从FeCl2溶液中制取FeCl2晶体 | |
| B. | 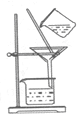 图:从制取Fe(OH)2胶体的混合物中提纯胶体 | |
| C. | 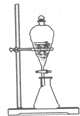 图:用CCl4萃取,从溴水中得到纯溴 | |
| D. | 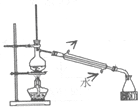 图:分离苯和甲苯 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 用洁净铂丝蘸取未知溶液进行焰色反应,呈黄色火焰,则该溶液有Na+,但不能确定K+的存在 | |
| B. | 实验室制取乙酸乙酯时,向试管中加入乙醇,然后边摇动试管边慢慢加入浓硫酸和冰醋酸 | |
| C. | 用已知浓度NaOH溶液滴定未知浓度盐酸,滴定终点时,俯视刻度线,则测得盐酸浓度偏小 | |
| D. | 相同温度下,可以通过观察气泡多少来比较不同浓度Na2SO3溶液与稀H2SO4溶液反应的快慢 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com