
|
用如图所示方法检验某固体中是否含有Cl-.关于溶液①和溶液②,下列说法正确的是
| |
| [ ] | |
A. |
①是BaCl2溶液,②是稀盐酸 |
B. |
①是稀盐酸,②是BaCl2溶液 |
C. |
①是稀HNO3,②是AgNO3溶液 |
D. |
①是稀H2SO4,②是AgNO3溶液 |
 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:阅读理解
| ||
| ||
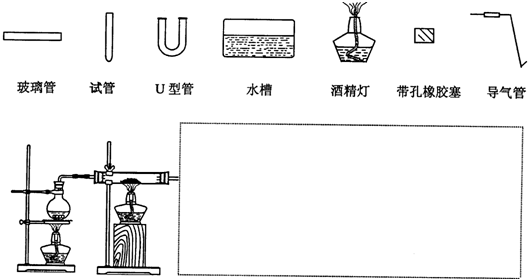
查看答案和解析>>
科目:高中化学 来源: 题型:阅读理解
| 操作 | 现象 | 结论 |
| 取少量除尽Ag+后的溶液于试管中,加入KSCN溶液,振荡 | ①溶液呈血红色 ①溶液呈血红色 |
存在Fe3+ |
| 取少量除尽Ag+后的溶液于试管中,加入 ②K3[Fe(CN)6]溶液 ②K3[Fe(CN)6]溶液 ,振荡 |
③产生蓝色沉淀 ③产生蓝色沉淀 |
存在Fe2+ |

| 实验编号 | 操作 | 现象 |
| a | 加入足量氨水,振荡 | 黑色固体不溶解 |
| b | 加入足量稀硝酸,振荡 | 黑色固体溶解,并有气体产生 |
查看答案和解析>>
科目:高中化学 来源: 题型:阅读理解
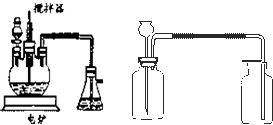 在中学化学实验中,通常用无水硫酸铜检验少量水的存在.由于无水硫酸铜吸湿性很强,需要现制现用.
在中学化学实验中,通常用无水硫酸铜检验少量水的存在.由于无水硫酸铜吸湿性很强,需要现制现用.
| ||
| ||
| ||
| ||


查看答案和解析>>
科目:高中化学 来源: 题型:阅读理解
| 化学式 | Fe | FeO | Fe2O3 | Fe3O4 | Fe(OH)2 | Fe(OH)3 |
| 颜色 | 银白色 | 黑色 | 红色 | 黑色 | 白色 | 红褐色 |
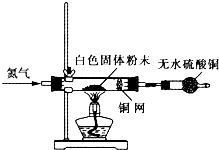
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com