
分析 I.(1)根据温度对水的电离平衡的影响判断;
(2)硫酸钠溶液显中性;
(3)t2温度下水的离子积常数是1×10-12,溶液为中性时溶液的pH=6;
(4)酸碱混合求pH,应先求出反应后剩余的氢离子的浓度,然后根据pH计算公式计算.
II.实验时应先称量一定质量的固体,溶解后配制成溶液,量取待测液与锥形瓶中,然后用标准液进行滴定,结合滴定操作的注意事项进行解答.
(1)实验时应先称量一定质量的固体,溶解后配制成溶液,量取待测液与锥形瓶中,然后用标准液进行滴定;
(2)滴定管垂直,液面不再变化时才可读数,视线与溶液凹液面最低点相平;
(3)滴定管0刻度在上,滴定前应调节到零刻度或零稍下的某一刻度;指示剂为甲基橙,变色范围为3.1-4.4;
(4)锥形瓶中的溶液是准确量取的,不能用待测溶液润洗.
解答 解:I.(1)水是弱电解质,存在电离平衡,电离过程为吸热,所以温度升高,水的电离程度增大,KW增大,因为25℃的Kw小于t℃的Kw,所以25<t,
故答案为:<;
(2)25℃时,某Na2SO4溶液中c(SO42-)=5×10-4 mol/L,则溶液中钠离子浓度是1×10-3 mol/L.如果稀释10倍,则钠离子浓度是1×10-4 mol/L.但硫酸钠溶液是显中性的,所以c(Na+):c(OH-)=10-4:10-7=1000:1,
故答案为:1000:1;
(3)t2温度下水的离子积常数是1×10-12,所以在该温度下,pH=6是显中性的.因此某溶液pH=7,该溶液显碱性,
故答案为:碱;
(4)25℃,KW=1×10-14,pH=13氢氧化钠溶液中c(OH-)=10-1mol/L;pH=1的盐酸中c(H+)=10-1mol/L,pH=2,c(H+)=10-2mol/L,混合溶液pH=2,说明酸碱中和后酸剩余,则c(H+)=$\frac{1{0}^{-1}×a-1{0}^{-1}×b}{a+b}$=10-2,解得a:b=9:11,
故答案为:9:11;
II.(1)实验时应先称量一定质量的固体,溶解后配制成溶液,量取待测液与锥形瓶中,然后用标准液进行滴定,具体步骤为:
B.在天平上准确称取烧碱样品w g,在烧杯中加蒸馏水溶解;
E.将溶液转移至250mL容量瓶中,加水至刻度线A.在250mL容量瓶中定容成250mL烧碱溶液;
C.用移液管(或碱式滴定管)量取25.00mL烧碱溶液于锥形瓶中并加几滴甲基橙作指示剂;
D.将物质的量浓度为m mol•L-1的标准H2SO4溶液装入酸式滴定管,调整液面,记下开始刻度数为V1 mL;
A.在锥形瓶下垫一张白纸,滴定到终点,记录终点酸的体积V2 mL.
故答案为:B、E、C、D、A;
(2)滴定管垂直,液面不再变化时才可读数,视线与溶液凹液面最低点相平,滴定管读数准确到0.01ml,
故答案为:视线与溶液凹液面最低点相平;
(3)滴定管0刻度在上,滴定前应调节到零刻度或零稍下的某一刻度;指示剂为甲基橙,变色范围为3.1-4.4,终点时溶液显酸性,溶液由黄色变为橙色,且半分钟内不恢复为原来的颜色;
故答案为:调节到零刻度或零稍下的某一刻度;溶液由黄色变为橙色,且半分钟内不恢复为原来的颜色;
(4)锥形瓶中的溶液是准确量取的,不能用待测溶液润洗,如润洗待测溶液的物质的量偏大,没有润洗无影响;
故答案为:无影响.
点评 本题考查了水的电离、水的离子积常数和pH的有关计算、弱电解质的电离平衡、酸碱中和滴定,题目难度中等,主要是巩固学生对教材基础知识的理解掌握程度,提高学生的解题能力.


科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
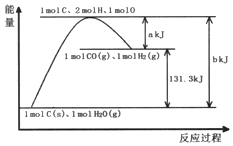
| A. | 1molC和1molH2O反应生成1molCO和1molH2一定吸收131.3kJ的热量 | |
| B. | 反应的热化学方程式可表示为C(s)+H2O(g)═CO(g)+H2(g)△H=(a-b)KJ/mol | |
| C. | 该反应过程反应物断键吸收的能量要小于生成物成键放出的能量 | |
| D. | 加入适当的催化剂,可以加快正、逆反应速率 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 聚氯乙烯分子中含有碳碳双键 | |
| B. | 油脂的皂化反应属于加成反应 | |
| C. | 糖类物质均可直接食用并能被人体吸收 | |
| D. | 以淀粉为原料可制取乙酸乙酯 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
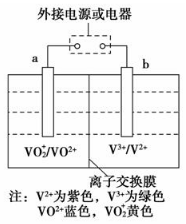 某可充电电池的原理如图所示,已知a、b为惰性电极,溶液呈酸性.充电时右槽溶液颜色由绿色变为紫色.下列叙述正确的是( )
某可充电电池的原理如图所示,已知a、b为惰性电极,溶液呈酸性.充电时右槽溶液颜色由绿色变为紫色.下列叙述正确的是( )| A. | 放电时,H+从左槽迁移进右槽 | |
| B. | 放电过程中,左槽溶液颜色由黄色变为蓝色 | |
| C. | 充电时,b极接直流电源正极,a极接直流电源负极 | |
| D. | 充电过程中,a极的电极反应式为:VO2++2H++e-═VO2++H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 原混合溶液中c(K+)为1 mol•L-1 | |
| B. | 上述电解过程中共转移4 mol电子 | |
| C. | 电解得到的Cu的物质的量为0.5 mol | |
| D. | 电解后溶液中c(H+)为2 mol•L-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 配制一定物质的量浓度溶液时,若加水超容最瓶刻度应用胶头滴管将多余溶液吸出 | |
| B. | 用容量瓶配制溶液,定容时俯视读数,所配溶液浓度偏大 | |
| C. | 欲配制1L1.0mol/L的NaCl溶液,可将58.5gNaCl溶于IL水中 | |
| D. | 稀释后的H2SO4未等冷却至室温可立即转移到容最瓶中 |
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
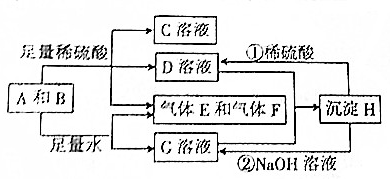
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 往0.3mol/L的NH3•H2O溶液中加入少量NaOH固体,NH3•H2O的电离平衡向逆反应方向移动,同时溶液中c(OH-)•c(NH4+)/c(NH3•H2O)将减小 | |
| B. | PH=9的NaOH溶液和NH3•H2O溶液中,由水电离出的c(H+)前者小于后者 | |
| C. | 浓度均为0.1mol/L的CH3COOH与CH3COONa溶液等体积混合后,PH=5,则混合溶液中:c(CH3COO-)-c(CH3COOH)=2×(10-5-10-9)mol/L | |
| D. | 相同条件下,将足量的氢氧化铁固体加入到相同体积的下列溶液:①蒸馏水②0.1mol/L氢氧化钠③0.1mol/L氢氧化钡④0.1mol/L氯化铁,则铁离子浓度:④>①>②═③ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com