
以黄铜矿(CuFeS2)为原料冶炼铜的反应为:
8CuFeS2+21O2 8Cu+4FeO3+2Fe2O3+16SO2
8Cu+4FeO3+2Fe2O3+16SO2
(1)若Cu为+2价,则反应中每生成1molCu需要转移 mol电子。
(2)为综合利用炉气中的大量SO2,下列方案合理的是 。
a.用浓硫酸吸收 b.用于制备硫酸
c.高空排放 d.用纯碱液吸收制亚硫酸钠
(3)为检验所得矿渣是中是否含有FeO、Fe2O3、CuO、A12O3、SiO2等氧化物,进行了以下实验;
①取一定量矿渣粉末,加入适量浓硫酸后加热,固体全部溶解,得溶液A;将产生的气体通入品红溶液中,溶液褪色。由此判断矿渣中一定含有 ,一定没有 。
②将溶液A稀释后分成两份,取其中一份,加入过量NaOH溶液,有沉淀产生,静置后取上层清液,通入过量的CO2溶液变浑浊。由此判断出矿渣中含有 ,写出通入过量的CO2所发生反应的离子方程式: 。
③取另一份溶液A加入过量的铁粉充分反应后过滤,得到的固体中有红色物质,由此判断矿渣中有 ,写出此步操作中得到红色物质所发生反应的离子方程式 。
科目:高中化学 来源: 题型:
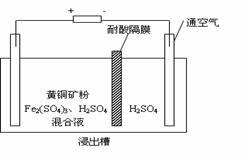 (8分)以石墨为电极,电解法处理黄铜矿(CuFeS2)精矿,可以制得硫酸铜溶液和单质硫。黄铜矿在阳极的浸出反应比较复杂,主要有:
(8分)以石墨为电极,电解法处理黄铜矿(CuFeS2)精矿,可以制得硫酸铜溶液和单质硫。黄铜矿在阳极的浸出反应比较复杂,主要有:
CuFeS2 + 4H+ = Cu2+ + Fe2+ + 2H2S,
CuFeS2 + 4Fe3+ = Cu2+ + 5Fe2+ + 2S,
2Fe3+ + H2S = 2H+ + S↓ + 2Fe2+。右图为该工艺的示意图。
(1)电解过程实现了Fe3+的循环,则阳极方程式为 ▲ 。
(2)电解过程中阴极析出的金属为 ▲ ,向阴极通空气的原因是 ▲ 。
(3)与燃烧法炼铜相比,电解法的优点为 ▲ 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com