
| A.NaNO2发生氧化反应 |
| B.NH4Cl中的氮元素被还原 |
| C.N2既是氧化产物,又是还原产物 |
| D.每生成1mol N2转移电子的物质的量为6mol |
科目:高中化学 来源:不详 题型:填空题
 Cl2↑+MnCl2+2H2O
Cl2↑+MnCl2+2H2O查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.若用标准状况下4.48LCH4还原NO2生成N2和水蒸气,放出热量为173.4 kJ/mol |
| B.由反应①可推知CH4(g)+4NO2(g)=4NO(g)+CO2(g)+2H2O(l)△H﹥-574kJ/mol |
| C.反应②中当4.48LCH4反应完全时转移的电子总数为1.60mol |
| D.反应①②转移的电子数相同 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
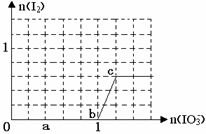
| A.0~b :3HSO3-+ IO3-= 3SO42-+ I-+ 3H+ |
| B.a点时消耗NaHSO3的物质的量为1.2 mol |
| C.b~c间I2是还原产物 |
| D.当溶液中I¯与I2的物质的量之比为5∶2时,加入的KIO3为1.8mol |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
 2HCOOH+O2,下列说法正确的是
2HCOOH+O2,下列说法正确的是| A.HCOOH分子中含有极性键,又有非极性键 |
| B.反应中,CO2被氧化,O2是还原产物 |
| C.反应中,每转移4×6.02×1022个电子,生成2.24L气体 |
| D.该过程是将太阳能转化为化学能的过程 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.原溶液的浓度为0.1mol/L |
| B.反应后溶液中c(Fe3+)=0.1mol/L |
| C.反应后溶液中c(Fe3+)=c(Fe2+) |
| D.原溶液中c(Br-)=0.4mol/L |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.M | B.M2+ | C.M3+ | D.MO2+ |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
 2Na2S+Na2SO3+3H2O。反应中氧化剂和还原剂的质量比为( )
2Na2S+Na2SO3+3H2O。反应中氧化剂和还原剂的质量比为( )| A.2∶7 | B.7∶2 | C.2∶1 | D.1∶2 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com