
| A.若v1=v2 c1=c2,则混合液中c(NH4+)=c(C1-) |
| B.若混合液的pH=7,则混合液中c(NH4+)>c(C1-) |
| C.若v1=v2且pH<7,则一定有c1<c2 |
| D.若混合液的pH=7,则c1v1>c2v2 |
 阶梯计算系列答案
阶梯计算系列答案科目:高中化学 来源:不详 题型:填空题
| A.c(Na+)=c(Cl-)>c(OH-)>c(NH4+) |
| B.c(Na+)=0.1 mol·L-1 |
| C.c(Na+)+c(NH4+)=c(Cl-)+c(OH-) |
| D.c(H+)>c(OH-) |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.水可以电离出离子,所以是强电解质 |
| B.水的离子积可表示KW=c(H+)·c(OH-) |
| C.常温下水中的c(H+)大于c(OH-) |
| D.升高温度,c(H+)增大,显弱酸性 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.用标准NaOH溶液滴定盐酸溶液以测定其浓度:酚酞试液——浅红色 |
| B.用标准FeCl3溶液滴定KI以测定其浓度:淀粉溶液——蓝色 |
| C.用标准酸性KMnO4溶液滴定Na2SO3溶液以测定其浓度:KMnO4溶液——紫红色 |
| D.利用“Ag++SCN-=AgSCN↓”原理,用标准KSCN溶液滴定AgNO3溶液以测定其浓度:FeCl3溶液——红色 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.溶液中四种粒子之间不可能满足:c(Na+)>c(OH-)>c(H+)>c(CH3COO-) |
| B.若溶液中部分粒子间满足:c(CH3COO-)=c(Na+),则该溶液一定呈中性 |
| C.若溶液中溶质仅为CH3COONa,则粒子间一定满足:c(Na+)>c(CH3COO-)>c(OH-)>c(H+) |
| D.若溶液中的溶质为CH3COONa和CH3COOH,则溶液中粒子间一定满足:c(CH3COO-)>c(Na+)>c(H+)>c(OH-) |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
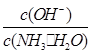 ________(填“增大”、“减小”或“不变”)。
________(填“增大”、“减小”或“不变”)。查看答案和解析>>
科目:高中化学 来源:不详 题型:实验题
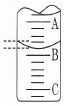
| 实验次数 | 第一次 | 第二次 | 第三次 |
| 消耗NaOH溶液体积/mL | 26.02 | 25.35 | 25.30 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com