
【题目】原子序数由小到大排列的五种短周期元素X、Y、Z、M、W,其中X是在周期表中原子半径最小的元素,Z 的最外层电子数是内层的3倍,Y、Z左右相邻,Z、W位于同主族,M与W同周期,且与X同主族。
(1)M元素是_______(填元素符号)。
(2)Z、W形成的气态氢化物中,较稳定的是_______(填化学式)。
(3)写出M2Z2的电子式:_______。
(4)由X、Y、Z、W四种元素中的三种组成的一种强酸,其稀溶液能与铜反应,离子方程式为_______。
(5)由X、Y、Z、W四种元素组成的一种离子化合物A,已知:
①1molA能与足量NaOH热的浓溶液反应生成标准状况下44.8L气体;
②A能与盐酸反应产生气体B,该气体能使品红溶液退色。
写出①中反应的化学方程式:_________。
【答案】Na H2O ![]() 3Cu+8H++2NO3- = 3Cu2++2NO+4H2O (NH4)2SO3+2NaOH=Na2SO3+2NH3+2H2O
3Cu+8H++2NO3- = 3Cu2++2NO+4H2O (NH4)2SO3+2NaOH=Na2SO3+2NH3+2H2O
【解析】
原子序数由小到大排列的五种短周期元素X、Y、Z、M、W,在周期表中X是原子半径最小的元素,则X为H元素;Z 的最外层电子数是内层的3倍,Z为O元素;Y、Z左右相邻,则Y为N元素;Z、W位于同主族,则W为S元素;M与W同周期,且与X同主族,则M为Na元素,据此分析解答。
根据上述分析,X为H元素,Y为N元素,Z为O元素,M为Na元素,W为S元素。
(1)根据上述分析可知,M为Na元素,故答案为:Na;
(2)非金属性O>S,故氢化物稳定性H2O>H2S,故答案为:H2O;
(3)Na2O2属于离子化合物,电子式为![]() ,故答案为:
,故答案为:![]() ;
;
(4)由H、N、O、S四种元素中的三种组成的一种强酸,该强酸的稀溶液能与铜反应,该酸为HNO3,Cu与稀硝酸反应得到硝酸铜、NO与水,反应离子方程式为:3Cu+8H++2NO3-=3Cu2++4H2O+2NO↑,故答案为:3Cu+8H++2NO3-=3Cu2++4H2O+2NO↑;
(5)由X、Y、Z、W四种元素组成的一种离子化合物A,则A为铵盐。①1molA能与足量NaOH热的浓溶液反应生成标准状况下44.8L气体,为氨气,说明该铵盐中含有2个铵根离子;②A能与盐酸反应产生气体B,该气体能使品红溶液退色,说明该铵盐中含有亚硫酸根离子,则A为(NH4)2SO3,则A与氢氧化钠反应的化学方程式为(NH4)2SO3+2NaOH=Na2SO3+2NH3+2H2O,故答案为:(NH4)2SO3+2NaOH=Na2SO3+2NH3+2H2O。


 智趣寒假作业云南科技出版社系列答案
智趣寒假作业云南科技出版社系列答案科目:高中化学 来源: 题型:
【题目】室温下,用相同浓度的NaOH溶液,分别滴定浓度均为0.1mol·L-1的三种酸(HA、HB和HD)溶液,滴定的曲线如图所示,下列判断错误的是( )

A. 三种酸的电离常数关系:KHA>KHB>KHD
B. 滴定至P点时,溶液中:c(B-)>c(Na+)>c(HB)>c(H+)>c(OH-)
C. pH=7时,三种溶液中:c(A-)=c(B-)=c(D-)
D. 当中和百分数达100%时,将三种溶液混合后:c(HA)+c(HB)+c(HD)=c(OH-)-c(H+)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列图示的四种实验操作名称从左到右依次是( )

A.过滤、蒸发、蒸馏、分液B.过滤、蒸馏、蒸发、分液
C.蒸发、蒸馏、过滤、分液D.分液、蒸馏、蒸发、过滤
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某温度下,向pH=6的蒸馏水中加入NaHSO4固体,保持温度不变,测得溶液pH为1。对于该溶液,下列叙述不正确的是
A. 该温度高于25℃
B. 由水电离出来的c(H+)=1×10-13mol/L
C. c(H+)+c(Na+)=c(OH-)+2c(SO42-)
D. 该温度下加入等体积pH为11的KOH溶液,可使反应后的溶液恰好呈中性
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列根据实验事实得出的结论错误的是( )
实验事实 | 结论 | |
A. | 某溶液中加入BaCl2溶液有白色沉淀生成 | 该溶液中一定含有SO42- |
B. | 加热时,铜能与浓硫酸反应 | 浓硫酸有强氧化性 |
C. | 某分散系具有丁达尔效应 | 该分散系是胶体 |
D. | Al(OH)3既能与盐酸反应,也能与NaOH溶液反应 | Al(OH)3是两性氢氧化物 |
A.AB.BC.CD.D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】翡翠的主要成分为 NaAlSi2O6,还含有其他多种金属阳离子。
(1)NaAlSi2O6所含元素中,第一电离能最小的元素和电负性最大的元素组成的含有两种化学键的化合物的名称为:______________________。
(2)Al的电子排布式为______________________。
(3)配合物K[Cr(C2O4)2(H2O)]中的配体是:___________,H2O的中心原子的杂化轨道类型是:___________,与H2O互为等电子体的离子是:___________(任写一种)
(4)Ca、O、Gr可以形成一种具有特殊导电性的复合氧化物,晶胞结构如图所示,其中Ca2+,O2-采用面心立方最密堆积方式。

①该晶体的化学式为:_______________。
②已知钙离子、氧离子半径分别为100pm、140pm,该晶胞的参数(边长)为________pm。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】透明聚酯玻璃钢可用于制造导弹的雷达罩和宇航员使用的氧气瓶。制备它的一种配方中含有下列四种物质:
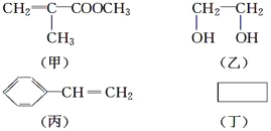
填写下列空白:
(1)甲中不含氧原子的官能团是___;下列试剂能与甲反应而褪色的是___(填字母)。
a.Br2/CCl4溶液 b.石蕊溶液 c.酸性KMnO4溶液
(2)甲的同分异构体有多种,写出其中一种不含甲基的羧酸的结构简式:____。
(3)已知:C2H5Br+NaOH![]() CH3CH2OH+NaBr,淀粉通过下列转化可以得到乙(CH2OHCH2OH):
CH3CH2OH+NaBr,淀粉通过下列转化可以得到乙(CH2OHCH2OH):
淀粉![]() A
A![]() B(C2H5OH)
B(C2H5OH)![]() C(C2H4)
C(C2H4)![]() D(C2H4Br2)
D(C2H4Br2)![]() 乙
乙
①A的分子式是____,试剂X可以是_____。
②写出由D生成乙化学方程式:_______。
(4)已知:
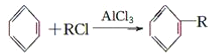 +HCl(-R为羟基)
+HCl(-R为羟基)
 +H2
+H2
根据已有知识并结合相关信息,写出以苯、乙烯、氯化氢为原料制备丙的合成路线流程图(无机试剂任用)。合成路线流程图示例如下:
CH3CH2Br![]() CH3CH2OH
CH3CH2OH![]() CH3COOCH2CH3______。
CH3COOCH2CH3______。
(5)写出丙在引发剂的条件下生成高分子化合物的化学方程式:_____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关说法正确的是( )
A. 1 mol Cl2参加反应转移电子数一定为2NA
B. 在反应KIO3+6HI=KI+3I2+3H2O中,每生成3 mol I2转移的电子数为6NA
C. 根据反应中HNO3(稀)![]() NO,而HNO3(浓)
NO,而HNO3(浓)![]() NO2可知,氧化性:HNO3(稀)>HNO3(浓)
NO2可知,氧化性:HNO3(稀)>HNO3(浓)
D. 含有大量NO3—的溶液中,不能同时大量存在H+、Fe2+、Cl-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某同学用如图所示装置探究原电池的工作原理,并推出下列结论,其中不正确的是( )
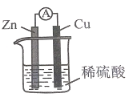
A.锌片不断溶解,说明Zn失去电子
B.铜片上产生气泡,说明溶液中H+在其表面得到电子
C.电流计指针发生偏转,说明该装置将电能转换为化学能
D.该装置中发生的总反应为Zn+H2SO4=ZnSO4+H2↑
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com