

| 绝热恒容(2L ) 密闭容器A | 恒温(T℃)恒容(2L) 密闭容器B | 恒温(T℃)恒压 密闭容器C | |
| 平衡常数K | KA | KB | KC |
| SO2的平衡转化率 | αA | αB | αC |
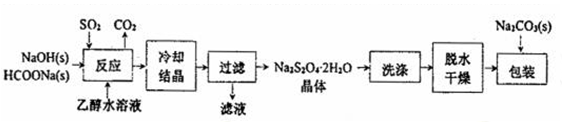
分析 I.由流程可知,反应中发生HCOO-+OH-+2SO2=S2O42-+CO2+H2O,乙醇可降低Na2S2O4的溶解度,冷却结晶、过滤分离出Na2S2O4.2H2O,洗涤、干燥后,加碳酸钠提高其稳定性;Na2S2O4溶液在空气中放置,可发生2Na2S2O4+O2+H2O=4NaHSO3 或 2Na2S2O4+O2+H2O=4NaHSO3+NaHSO4;
II.2SO2(g)+O2(g)$?_{加热}^{催化剂}$2SO3(g)为气体体积减小的反应,且为放热反应;
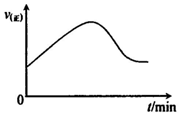
(1)绝热恒容密闭容器中,通入一定量的SO2和O2,温度升高,正反应速率增大;然后平衡逆向移动,直到达到新平衡;
(2)B、C温度相同、K相同,A中反应放热使温度升高,平衡逆向移动;恒压时气体的体积减小,相等于加压,平衡正向移动的程度大,以此来解答.
解答 解:I.(1)Na2S2O4中的硫+3价,S元素的化合价由+4降为+3价,由电子得失守恒可知,HCOONa中的碳的化合价必然升高,由+2价变成+4价,生成二氧化碳,由电子、原子守恒可知反应为2HCOONa+4SO2+Na2CO3═2Na2S2O4+H2O+3CO2,其离子反应为HCOO-+OH-+2SO2=S2O42-+CO2+H2O,
故答案为:HCOO-+OH-+2SO2=S2O42-+CO2+H2O;
(2)由信息可知在碱性介质中稳定,则在包装保存“保险粉”时加入少量的Na2CO3固体,目的是Na2CO3为碱性物质,提高“保险粉”的稳定性,
故答案为:Na2CO3为碱性物质,提高“保险粉”的稳定性;
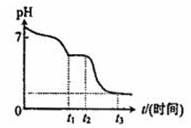
(3)Na2S2O4溶液在空气中易被氧化生成亚硫酸氢钠,则0~t1段发生离子反应方程式为2S2O42-+O2+2H2O=4HSO3-,t1~t2段溶液中NaHSO3电离显酸性,则t1~t2段溶液中S元素的化合价为+4价,t3时S2O42-被氧化生成SO42-,溶液的溶质为NaHSO4,由S原子守恒可知,其浓度为0.05mol/L×2=0.1mol/L,溶液的pH=1,
故答案为:+4;1;
II.2SO2(g)+O2(g)$?_{加热}^{催化剂}$2SO3(g)为气体体积减小的反应,且为放热反应,则此反应的△S<0,△H<0,
故答案为:<;<;
(1)绝热恒容密闭容器中,通入一定量的SO2和O2,温度升高,正反应速率增大;然后平衡逆向移动,直到达到新平衡,则从开始经一段时间正反应速率[v(正)]随时间(t)的变化曲线图为 ,故答案为:
,故答案为: ;
;
(2)B、C温度相同、K相同,A中反应放热使温度升高,平衡逆向移动,则三容器中反应分别平衡时K的大小关系为KA<KB=KC;恒压时气体的体积减小,相等于加压,平衡正向移动的程度大,则B、C比较可知αB<αC,A、B的温度不同,A中升高温度平衡逆向移动,则转化率αA<αB,则SO2的平衡转化率的大小关系是αA<αB<αC,故答案为:KA<KB=KC;αA<αB<αC.
点评 本题考查物质的制备实验及化学平衡,为高频考点,把握制备流程中的反应、化学平衡移动及K和转化率的判断为解答的关键,侧重分析与应用能力的考查,综合性较强,Na2S2O4的氧化反应为解答的难点,题目难度不大.


科目:高中化学 来源: 题型:选择题
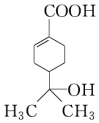
| A. | 分子中含有两种官能团 | |
| B. | 可使溴水和酸性高锰酸钾溶液褪色,且原理相同 | |
| C. | 该有机物的分子式为C10H16O3 | |
| D. | 与钠和氢氧化钠溶液都能发生反应,且得到的产物相同 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
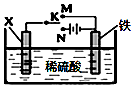
| A. | 若X为锌棒,开关K置于M处,为外加电流阴极保护法 | |
| B. | 若X为碳棒,开关K置于N处,为牺牲阳极阴极保护法 | |
| C. | 若X为锌棒,开关K置于M处,Zn极发生:Zn-2e-→Zn2+ | |
| D. | 若X为碳棒,开关K置于N处,X极发生还原反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 元素代号 | X | Y | Z | W |
| 原子半径/nm | 0.160 | 0.143 | 0.070 | 0.066 |
| 主要化合价 | +2 | +3 | +5、+3、-3 | -2 |
| A. | 元素的金属性:X<Y | |
| B. | 原子Z的价电子数为5 | |
| C. | 元素的简单离子半径:r(X2+)>r(W2-) | |
| D. | 元素Y的最高价氧化物对应的水化物能溶于氨水 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | 甲装置工作过程中pH增大 | |
| B. | 乙装置中石墨电极反应式为C-4e-+2O2-═CO2↑ | |
| C. | 甲装置中通入O2的电极反应式为:O2+4e-+4H+═2H2O | |
| D. | 若不考虑装置的损失,制备24.0g金属钛,需要消耗氢气22.4L |
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
| 元素编号 | 特征信息 |
| A | 有一种原子内只有质子,没有中子 |
| B | L层电子数是K层的3倍 |
| C | 其阳离子与B的阴离子具有相同的电子层结构,且核电荷数与B相差3 |
| D | 最外层电子数等于电子层数,且是地壳中含量较多的元素之一 |
| E | 单质为黄绿色,可用于制造漂白粉 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 原子半径:r(X)<r(Y)<r(Z)<r(W) | |
| B. | 元素X、Y组成的化合物只有两种 | |
| C. | W的简单气态氢化物的热稳定性比Y的弱 | |
| D. | Q、Z的简单离子具有相同的电子层结构 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 温度 | 250℃ | 300℃ | 350℃ |
| K | 2.041 | 0.270 | 0.012 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com