
【题目】某学生用已知物质的量浓度的盐酸来测定未知物质的量浓度的NaOH溶液时,选择甲基橙作指示剂。请填写下列空白:
(1)用标准的盐酸滴定待测的NaOH溶液时,左手握酸式滴定管的活塞,右手摇动锥形瓶,眼睛注视________,直到因加入一滴盐酸后,溶液由黄色变为橙色,并______为止。
(2)下列操作中可能使所测NaOH溶液的浓度数值偏低的是( )
A.酸式滴定管未用标准盐酸润洗就直接注入标准盐酸
B.滴定前盛放NaOH溶液的锥形瓶用蒸馏水洗净后没有干燥
C.酸式滴定管在滴定前有气泡,滴定后气泡消失
D.读取盐酸体积时,开始仰视读数,滴定结束时俯视读数
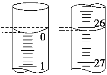
(3)若滴定开始和结束时,酸式滴定管中的液面如图所示,则起始读数为________mL,终点读数为________mL,所用盐酸溶液的体积为________mL。
(4)某学生根据3次实验分别记录有关数据如下表:
滴定次数 | 待测NaOH溶液的体积/mL | 0.100 0 mol·L-1盐酸的体积/mL | ||
滴定前刻度 | 滴定后刻度 | 溶液体积/mL | ||
第一次 | 25.00 | 0.00 | 26.11 | 26.11 |
第二次 | 25.00 | 1.56 | 30.30 | 28.74 |
第三次 | 25.00 | 0.22 | 26.31 | 26.09 |
依据上表数据列式计算该NaOH溶液的物质的量浓度。
【答案】(1)锥形瓶中溶液颜色变化 在半分钟内不变色
(2)D (3)0.00 26.10 26.10
(4)![]() =
=![]() =26.10 mL,
=26.10 mL,
c(NaOH)=![]() =0.104 4 mol·L-1
=0.104 4 mol·L-1
【解析】在求c(NaOH)和进行误差分析时应依据公式:c(NaOH)=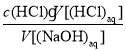 。欲求c(NaOH),须先求V[(HCl)aq]再代入公式;进行误差分析时,要考虑实际操作对每一个量即V[(HCl)aq]和V[(NaOH)aq]的影响,进而影响c(NaOH)。
。欲求c(NaOH),须先求V[(HCl)aq]再代入公式;进行误差分析时,要考虑实际操作对每一个量即V[(HCl)aq]和V[(NaOH)aq]的影响,进而影响c(NaOH)。
(1)考查酸碱中和滴定实验的规范操作。
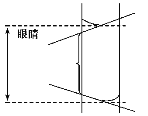
(2)考查由于不正确操作引起的误差分析。滴定管未用标准盐酸润洗,内壁附着一层水,可将加入的盐酸稀释,消耗相同量的碱,所需盐酸的体积偏大,结果偏高;用碱式滴定管取出的待测NaOH溶液的物质的量一旦确定,倒入锥形瓶后,水的加入不影响OH-的物质的量,也就不影响结果;若排出气泡,液面会下降,故读取V酸偏大,结果偏高;正确读数(虚线部分)和错误读数(实线部分)如图所示。
(3)读数时,以凹液面的最低点为基准。
(4)先算出耗用标准酸液的平均值
![]() =
=![]() =26.10 mL (第二次偏差太大,舍去)。
=26.10 mL (第二次偏差太大,舍去)。
c(NaOH)=![]() =0.104 4 mol·L-1。
=0.104 4 mol·L-1。


科目:高中化学 来源: 题型:
【题目】下图是由短周期元素组成的一些单质及其化合物之间的转化关系图。常温常压下,D、F、K均为无色无刺激性气味的气体,B是最常见的无色液体,A是由单质C在D中燃烧生成的淡黄色固体。(反应中生成的部分物质已略去)

请回答下列问题:
(1)物质A的化学式为__________。组成单质C的原子结构示意图__________。
(2)反应①的化学方程式为__________;反应②的化学方程式为__________。
(3)设计实验验证一包纯净物是H_______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列物质分子中,各原子不处于同一平面的是:①甲苯;②乙炔;③乙烯;④乙烷;⑤甲烷;⑥苯;⑦丙烯.( )
A.②③⑦
B.①④⑥
C.②③⑥
D.①④⑤⑦
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将后者逐渐滴入(或通入)前者至过量,有沉淀产生且最终消失的是( )
A. 氯化铝、氨水 B. 氢硫酸、氧气
C. 硫酸铝、氢氧化钠 D. 氯化亚铁、氯气
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下面提到的问题中,与盐的水解无关的正确说法是
A. 实验室盛放碳酸钠溶液的试剂瓶必须用橡胶塞而不能用玻璃塞
B. 明矾或FeCl3可作净水剂
C. 厨房中常用碳酸钠溶液洗涤餐具上的油污
D. 可用碳酸钠与醋酸制取少量二氧化碳
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】随着卤族元素原子序数递增,下列说法正确的是( )
A.单质的氧化性逐渐减弱
B.单质的熔、沸点逐渐降低
C.单质的密度逐渐降低
D.气态氢化物的稳定性逐渐增强
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com