
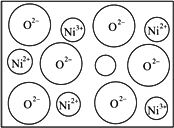
天然的和绝大部分人工制备的晶体都存在各种缺陷,例如在某种NiO晶体中就存在如下图所示的缺陷:一个Ni2+空缺,另有两个Ni2+被两个Ni3+所取代.结果晶体仍呈电中性,但化合物中Ni和O的比值却发生了变化.某氧化镍样品组成为Ni0.97O,试计算该晶体中Ni3+与Ni2+的离子数之比.
 期末集结号系列答案
期末集结号系列答案科目:高中化学 来源: 题型:
 (1)中学教材上图示了NaCl晶体结构,它向三维空间延伸得到完美晶体. NiO(氧化镍〕晶体的结构与NaQ相同,Ni2+与最邻近O2-的核间距离为a10-8cm,计算NiO晶体的密度(已知NiO的摩尔质量为74.7g.mol-1).
(1)中学教材上图示了NaCl晶体结构,它向三维空间延伸得到完美晶体. NiO(氧化镍〕晶体的结构与NaQ相同,Ni2+与最邻近O2-的核间距离为a10-8cm,计算NiO晶体的密度(已知NiO的摩尔质量为74.7g.mol-1).查看答案和解析>>
科目:高中化学 来源: 题型:
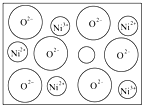 天然的和绝大部分人工制备的晶体都存在各种缺陷,例如在某种NiO晶体中就存在如图所示的缺陷:一个Ni2+空缺,另有两个Ni2+被两个Ni3+所取代.其结果晶体仍呈电中性,但化合物中Ni和O的比值却发生了变化.其氧化镍样品组成为Ni0.97O,试计算该晶体中Ni2+与Ni3+的离子数之比.
天然的和绝大部分人工制备的晶体都存在各种缺陷,例如在某种NiO晶体中就存在如图所示的缺陷:一个Ni2+空缺,另有两个Ni2+被两个Ni3+所取代.其结果晶体仍呈电中性,但化合物中Ni和O的比值却发生了变化.其氧化镍样品组成为Ni0.97O,试计算该晶体中Ni2+与Ni3+的离子数之比.查看答案和解析>>
科目:高中化学 来源: 题型:
 【化学-选修物质结构与性质】
【化学-选修物质结构与性质】查看答案和解析>>
科目:高中化学 来源: 题型:

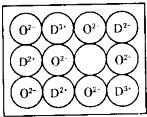
(2)天然的和绝大部分人工制备的晶体都存在各种缺陷,例如在某种NiO晶体中就存在如图的缺陷:一个Ni2+空缺,另有两个Ni2+被两个Ni3+所取代。其结果晶体仍呈电中性,但化合物中Ni和O的比值却发生了变化。某氧化镍样品的组成为Ni0.97O,试计算该晶体中Ni3+与Ni2+的离子数之比。
查看答案和解析>>
科目:高中化学 来源: 题型:
(1)中学教材上图示了NaCl晶体的结构,它向三维空间延伸形成完美晶体。氧化镍(NiO)晶体的结构与NaCl相同,Ni2+与最邻近的O2-核间距离为a×10-8 cm。计算NiO晶体的密度(已知NiO的摩尔质量为74.7 g· mol-1)。
(2)天然的和绝大部分人工制备的晶体都存在各种缺陷,例如在某种NiO晶体中就存在如下图的缺陷:一个Ni2+空缺,另有两个Ni2+被两个Ni3+所取代。其结果晶体仍呈电中性,但化合物中Ni和O的个数比却发生了变化。某氧化镍样品的组成为Ni0.97O,试计算该晶体中Ni3+与Ni2+的离子数之比。

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com