
| A. | 都是含氧酸 | B. | 都是一元酸 | ||
| C. | 都易挥发 | D. | 都能发生中和反应 |
 名师指导期末冲刺卷系列答案
名师指导期末冲刺卷系列答案 开心蛙口算题卡系列答案
开心蛙口算题卡系列答案科目:高中化学 来源: 题型:解答题
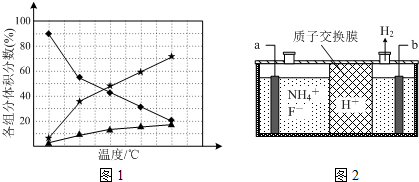
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
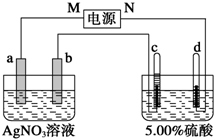 图中电极a、b分别为Ag电极和Pt电极,电极c、d都是石墨电极.通电一段时间后,在c、d两极上共收集到336mL (标准状况)气体.回答:
图中电极a、b分别为Ag电极和Pt电极,电极c、d都是石墨电极.通电一段时间后,在c、d两极上共收集到336mL (标准状况)气体.回答:查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 A、B、C、D、E均为有机物,其中A是化学实验中最常见的有机物,它易溶于水并有特殊香味;B的产量可衡量一个国家石油化工发展的水平,有关物质的转化关系如图所示:
A、B、C、D、E均为有机物,其中A是化学实验中最常见的有机物,它易溶于水并有特殊香味;B的产量可衡量一个国家石油化工发展的水平,有关物质的转化关系如图所示:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | $\frac{a+b+c}{V}$mol•L-1 | B. | $\frac{a+b+2c}{V}$mol•L-1 | C. | $\frac{2a+b+c}{V}$mol•L-1 | D. | $\frac{b+2c}{V}$mol•L-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 向明矾溶液中加入过量的氢氧化钡溶液:Al3++2SO42-+2Ba2++4OH-═2BaSO4↓+AlO2-+2H2O | |
| B. | 钠与水反应:Na+2H2O═Na++2OH-+H2↑ | |
| C. | 碳酸氢钙与少量澄清石灰水反应:Ca2++2OH-+2HCO3-═CaCO3↓+CO32-+2H2O | |
| D. | 强碱溶液中,次氯酸钠与Fe(OH)2:3ClO-+2Fe(OH)2═2FeO42-+3Cl-+H2O+4H+ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 用分液漏斗分离水与乙醇的混合物 | |
| B. | 用激光笔检验淀粉溶液的丁达尔现象 | |
| C. | 用氯化钡溶液鉴别碳酸钠溶液与硫酸钠溶液 | |
| D. | 向饱和FeCl3溶液中滴加过量氨水,可制取Fe(OH)3胶体 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 4HCN(浓)+MnO2$\frac{\underline{\;\;△\;\;}}{\;}$Mn(CN)2+(CN)2↑+2H2O | |
| B. | (CN)2+H2O═2H++CN-+CNO- | |
| C. | (CN)2+2OH-═CN-+CNO-+H2O | |
| D. | (CN)2+2SCN-═2CN-+(SCN)2 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
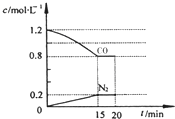 回答下列问题:
回答下列问题:查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com