
| A. | 鉴别Na2CO3和NaHCO3可用Ba(OH)2或Ca(OH)2溶液 | |
| B. | 除去Na2CO3固体中混有的少量NaHCO3,可采用加热法 | |
| C. | CO2中混有少量HCl、SO2等气体时,可用饱和NaHCO3溶液提纯气体 | |
| D. | 将澄清石灰水滴入NaHCO3溶液中,开始时发生反应的离子方程式为:Ca2++2OH-+2HCO3-═CaCO3↓+CO32-+2H2O |
分析 A.Na2CO3和NaHCO3均与Ba(OH)2或Ca(OH)2溶液反应生成白色沉淀;
B.NaHCO3加热分解生成碳酸钠;
C.HCl、SO2等气体均与饱和NaHCO3溶液反应生成二氧化碳;
D.澄清石灰水少量完全反应,生成碳酸钙、水、碳酸钠.
解答 解:A.Na2CO3和NaHCO3均与Ba(OH)2或Ca(OH)2溶液反应生成白色沉淀,现象相同,不能鉴别,故A错误;
B.NaHCO3加热分解生成碳酸钠,则加热可分离提纯,故B正确;
C.HCl、SO2等气体均与饱和NaHCO3溶液反应生成二氧化碳,则用饱和NaHCO3溶液、洗气提纯气体,故C正确;
D.澄清石灰水少量完全反应,生成碳酸钙、水、碳酸钠,则开始时发生反应的离子方程式为Ca2++2OH-+2HCO3-═CaCO3↓+CO32-+2H2O,故D正确;
故选A.
点评 本题考查物质的鉴别和检验,为高频考点,把握物质的性质、发生的反应及混合物分离提纯方法为解答的关键,侧重分析与应用能力的考查,注意元素化合物知识的应用,题目难度不大.


科目:高中化学 来源: 题型:解答题
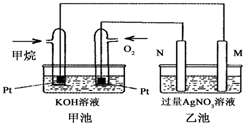 如图是一个甲烷燃料电池工作时的示意图,乙池中的两个电极一个是石墨电极,一个是铁电极,工作时N电极的质量减少,请回答下列问题:
如图是一个甲烷燃料电池工作时的示意图,乙池中的两个电极一个是石墨电极,一个是铁电极,工作时N电极的质量减少,请回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 使用SO2漂白过的物品在使用过程中会慢慢恢复为漂白前的颜色 | |
| B. | 向含有纯碱的废水中加入适量生石灰,可以消除水中的污染 | |
| C. | 大量焚烧田间秸秆会促进雾霾的形成 | |
| D. | 用热碱水吸收有利于除去手上的油脂形成的污渍 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 在加入铝粉能产生氢气的溶液中:NH4+、Fe2+、SO42-、NO3- | |
| B. | 室温下由水电离出的氢离子浓度c(H+)=1×10-14mol/L的溶液中:Ba2+、NO3-、K+、ClO- | |
| C. | 能使酚酞变红色的溶液中:Na+、K+、AlO2-、CO32- | |
| D. | 在c(HCO3-)=0.1 mol•L-1的溶液中:NH4+、AlO2-、Cl-、NO3- |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:填空题
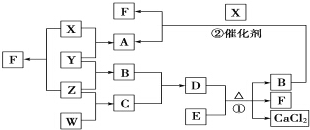 X、Y、Z、W均为气体单质,A、B、C均为无色气体化合物,D、E均为白色固体,F在通常情况下为无色无味的液体,它们有如下的转化关系:
X、Y、Z、W均为气体单质,A、B、C均为无色气体化合物,D、E均为白色固体,F在通常情况下为无色无味的液体,它们有如下的转化关系: ,F中的化学键类型为共价键.
,F中的化学键类型为共价键.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 离子 | Cu2+ | H+ | Cl- | SO42- |
| 浓度(c/mol•L-1) | 0.5 | 2 | 2 | 0.5 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com