
【题目】常温下,下列叙述不正确的是( )
A. c(H+)>c(OH-)的溶液一定显酸性
B. 将0.1 mol·L-1HI溶液加水稀释l00倍,溶液中所有离子的浓度随之减小
C. 常温下pH=5的硫酸溶液稀释到原来的1000倍,稀释后c(SO42-)与c(H+)之比约为1∶20
D. 常温下的纯水加热到40℃,pH减小
 世纪百通期末金卷系列答案
世纪百通期末金卷系列答案科目:高中化学 来源: 题型:
【题目】已知A为常见的金属单质,根据如图所示的转化关系回答下列问题。

(1)确定A、B、C、D、E、F的化学式:A________,B________,C________,D________,E________,F________。
(2)写出⑧的化学方程式及④、⑤的离子方程式:
⑧的化学方程式________________________________________。
④的离子方程式:__________________________。
⑤的离子方程式:__________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用丙醛(CH3-CH2-CHO)制取聚丙烯的过程中发生的反应类型为 ( )
①取代 ②消去 ③加聚 ④缩聚 ⑤氧化 ⑥还原
A.①④⑥B.⑤②③C.②④⑤D.⑥②③
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】BPA的结构简式如右下图所示,常用来生产防碎塑料聚碳酸酯。

(1)该物质的分子式为___________,含氧官能团的名称是_________,属于____类。
(2)该物质最多_____个碳原子共面。
(3)充分燃烧0.1mol该有机物,消耗的O2在标准状况下的体积为_________。
(4)下列关于BPA的叙述中,不正确的是_______。
A.可以发生还原反应
B.遇FeCl3溶液紫色
C.1mol该有机物最多可与2molH2反应
D.可与NaOH溶液反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】水泥是重要的建筑材料。水泥熟料的主要成分为CaO、SiO2,并含有一定量的铁和铝等金属的氧化物。实验室测定水泥样品中钙含量的过程如图所示:
(1)在溶解水泥样品过程中,以盐酸为溶剂,氯化铵为助溶剂,还需加入几滴硝酸。加入硝酸的目的是_____ ,还常使用_____ (填一种) 等物质代替硝酸。
(2)沉淀A的主要成分能与氢氟酸发生反应,该反应的化学方程式为__________。
(3)沉淀B 的主要成分有_____ (填化学式)。
(4)加氨水的过程中,加热的目的是__________。
(5)草酸钙沉淀经稀H2SO4处理后,用KMnO4标准溶液滴定,通过测定草酸的量可间接获知钙的含量,滴定过程中发生反应的离子方程式为._________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某学生实验兴趣小组拟用图1装置气体排液法来完成“NaHCO3和NaCl混合物中NaHCO3含量的测定”的实验.
已知:Na2CO3+CO2+H2O=2NaHCO3 , CO2难溶于饱和NaHCO3溶液.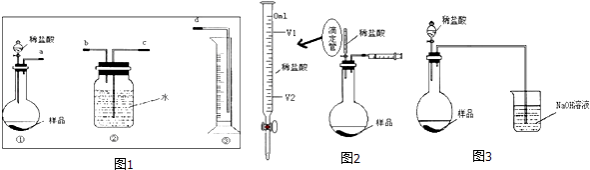
(1)各仪器接口连接顺序是(用接口字母填写).
(2)甲同学认为上述方法误差较大,提出如下改进措施,你认为可行的有 . (填序号)
A.在装置②中水面上滴加少量植物油
B.在装置①中稀盐酸换成稀硫酸,装置②中水换成饱和NaHCO3溶液
C.在装置②中水换成饱和Na2CO3溶液
D.滴加盐酸不宜过快
(3)乙同学认为在装置②③之间的导管内会积存水,使测定结果不准,从而改用图2装置.假定滴定管(用于准确测定滴加液体体积的仪器,其中0刻度在最上面,刻度从上到下依次增大)起始读数为V1mL,终了读数为V2mL,而注射器测定排出的气体为V3mL(标准状况下),混合物样品质量为m g,则原混合物中NaHCO3的质量分数的表达式为(用含V1、V2、V3、m的式子表示).
(4)丙同学改用图3装置,通过测定烧杯中NaOH溶液的增重来确定样品中NaHCO3的含量.你认为乙、丙两同学的方案中,谁的方案更合理 , 理由是: 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列措施对增大反应速率明显有效的是( )。
A. Na与水反应时增大水的用量
B. 将铝片改为铝粉,做铝与氧气反应的实验
C. 在K2SO4与BaCl2两溶液反应时,增大压强
D. Fe与稀硫酸反应制取氢气时,改用浓硫酸
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将等pH等体积的HCl和CH3COOH分别稀释m倍和n倍,稀释后两溶液的pH仍相等,则m__________n(填“大于”、“等于”或“小于”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定温度下,在某密闭容器中发生反应:2HI(g)![]() H2(g)+I2(s)ΔH >0,若0~15 s内c(HI)由0.1 mol·L-1降到0.07 mol·L-1,则下列说法正确的是( )
H2(g)+I2(s)ΔH >0,若0~15 s内c(HI)由0.1 mol·L-1降到0.07 mol·L-1,则下列说法正确的是( )
A. 0~15 s内用I2表示的平均反应速率为v(I2)=0.001 mol·L-1·s-1
B. c(HI)由0.07 mol·L-1降到0.05 mol·L-1所需的反应时间小于10 s
C. 升高温度正反应速率加快,逆反应速率也加快
D. 减小反应体系的体积,正逆反应速率增大程度相等
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com