
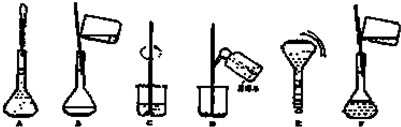
分析 (1)需用CuSO4•5H2O体配制480mL0.1mol/L的CuSO4溶液,应选择500mL容量瓶,实际配制500mL溶液,依据m=CVM计算需要溶质的质量;
(2)托盘天平称量原理:左盘的质量=右盘的质量+游码的质量;
(3)依据操作步骤选择需要仪器;
(4)依据配制一定物质的量浓度溶液的一般步骤排序;依据定容的正确操作解答;
(5)分析操作对溶质的物质的量n和溶液体积V的影响,依据C=$\frac{n}{V}$进行误差分析,凡是能够使n偏大或者使V偏小的操作,溶液浓度偏高,反之,溶液浓度偏低.
解答 解:(1)需用CuSO4•5H2O体配制480mL0.1mol/L的CuSO4溶液,应选择500mL容量瓶,实际配制500mL溶液,依据m=CVM=0.1mol/L×0.5L×250g/mol=12.5g;
故答案为:12.5;
(2)托盘天平称量原理:左盘的质量=右盘的质量+游码的质量,物码放反则物质的质量=12g-0.5g=11.5g;
故答案为:11.5;
(3)配制一定物质的量浓度溶液的一般步骤:计算、称量、溶解、冷却、移液、洗涤、定容、摇匀、装瓶,用到的仪器:托盘天平、量筒、烧杯、玻璃棒、500mL容量瓶、胶头滴管,所以还缺少的仪器:500mL容量瓶、胶头滴管;
故答案为:500mL容量瓶、胶头滴管;
(4)配制一定物质的量浓度溶液的一般步骤:计算、称量、溶解、冷却、移液、洗涤、定容、摇匀、装瓶,所以正确的操作顺序为:CBDFAE;
定容的正确操作为:向容量瓶中加入蒸馏水,到液面离刻度线1-2cm时,改用胶头滴管滴加蒸馏水到凹液面最低点与刻度线相切;
故答案为:CBDFAE;向容量瓶中加入蒸馏水,到液面离刻度线1-2cm时,改用胶头滴管滴加蒸馏水到凹液面最低点与刻度线相切;
(5)①定容时俯视刻度线,导致溶液体积偏小,溶液浓度偏高,故选A;
②所用CuSO4•5H2O晶体已失去部分结晶水,导致称取的物质中含有溶质硫酸铜的物质的量偏大,溶液浓度偏高,故选A;
故答案为:A.A.
点评 本题考查了一定物质的量浓度溶液的配制,熟悉配制原理,明确操作步骤是解题关键,注意误差分析的方法和技巧.


科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
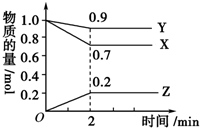 某温度时,在2L容器中,X、Y、Z三种物质的物质的量随时间变化曲线如图所示.由图中数据分析,该反应的化学方程式为Y+3X?2Z,反应开始至2min,X的转化率为30%.
某温度时,在2L容器中,X、Y、Z三种物质的物质的量随时间变化曲线如图所示.由图中数据分析,该反应的化学方程式为Y+3X?2Z,反应开始至2min,X的转化率为30%.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 操作和现象 | 结论 | |
| A | 取某溶液少许,加入酸化的Ba(NO3)2溶液,产生白色沉淀 | 该溶液一定含SO42- |
| B | NaHCO3溶液与NaAlO2溶液混合产生白色沉淀 | 结合H+的能力:CO32-<AlO2- |
| C | 某溶液加入盐酸产生使石灰水变浑浊的无色无味气体 | 该溶液肯定含HCO3-、CO32-中的一种或二种 |
| D | 测定等浓度的Na2CO3和Na2SO3溶液的pH;前者pH比后者的大; | 非金属性:S>C |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
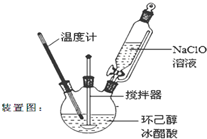 环己酮是重要化工原料,是制造尼龙、己内酰胺和己二酸的主要中间体.某化学兴趣小组尝试用次氯酸钠制备环己酮.方程式为:
环己酮是重要化工原料,是制造尼龙、己内酰胺和己二酸的主要中间体.某化学兴趣小组尝试用次氯酸钠制备环己酮.方程式为: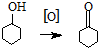
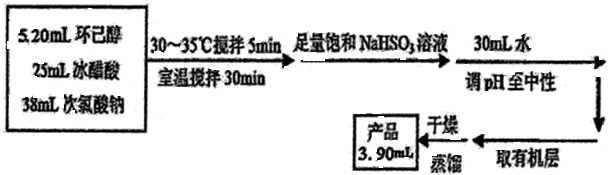
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
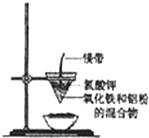 研究性学习小组的同学们用如图所示装置进行铝热反应的实验,请回答:
研究性学习小组的同学们用如图所示装置进行铝热反应的实验,请回答:| 物质 | Al | Al2O3 | Fe | Fe2O3 |
| 熔点/℃ | 660 | 2054 | 1535 | 1462 |
| 沸点/℃ | 2467 | 2980 | 2750 | - |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 0.05NA | B. | 0.1NA | ||
| C. | 0.15NA | D. | 条件不足,不能计算 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Cl2 HCl | B. | ClO2 NaClO2 | C. | NaCl HClO | D. | KClO3 Ca(ClO3)2 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com