
| A. | ③④⑦ | B. | ①⑦ | C. | ⑤⑥ | D. | ①⑥⑧ |
分析 ①在一定量AgNO3溶液中,滴加氨水至沉淀恰好溶解可制得银氨溶液;
②配制Cu(OH)2悬浊液:在一定量CuSO4溶液中,加入过量NaOH溶液;
③水解后加酸至酸性,再检验卤素离子;
④无水乙醇和浓硫酸共热至170℃,发生消去反应生成乙烯,乙醇易挥发,乙烯、乙醇均能被酸性高锰酸钾氧化;
⑤乙烷中乙烯的含量未知,不能确定通入氢气的量,易引入杂质;
⑥三溴苯酚和溴都易溶于苯中;
⑦实验室制取乙烯时测的是液体的温度;
⑧溴与KI反应生成碘,碘易溶于溴苯.
解答 解:①银氨溶液的配制方法:取一洁净试管,加入2 mL 2%的AgNO3溶液,再逐滴滴入2%的稀氨水,至生成的沉淀恰好溶解,故正确;
②新制Cu(OH)2悬浊液的配制方法:在试管里加入10%NaOH溶液2 mL,滴入2%CuSO4溶液4~6滴,故错误;
③水解后加酸至酸性,再检验卤素离子,则把RX与烧碱水溶液混合加热,将溶液冷却后先加硝酸至酸性,再加入硝酸银溶液来检验,故错误;
④无水乙醇和浓硫酸共热至170℃,发生消去反应生成乙烯,乙醇易挥发,乙烯、乙醇均能被酸性高锰酸钾氧化,不能检验,应除去乙醇,再检验乙烯,故错误;
⑤乙烷中乙烯的含量未知,不能确定通入氢气的量,易引入杂质,且反应在实验室难以完成,故错误;
⑥苯酚和溴水反应生成三溴苯酚,三溴苯酚溶于苯中,应用氢氧化钠溶液除杂,故错误;
⑦实验室制取乙烯时测的是液体的温度,所以必须将温度计的水银球插入反应液中,以控制反应液的温度,故正确;
⑧溴与KI反应生成碘,碘易溶于溴苯,引入新杂质,不能除杂,应选NaOH溶液、分液,故错误;
故选B.
点评 本题考查化学实验方案的评价,为高频考点,涉及混合物分离提纯、银氨溶液配制、有机物的结构与性质、物质检验等,把握物质的性质、反应原理、实验技能为解答的关键,注意实验的评价性分析,题目难度不大.


 小学教材全测系列答案
小学教材全测系列答案科目:高中化学 来源: 题型:解答题
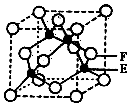 A、B、C、D、E、F是元素周期表前四周期中的常见元素,原子序数依次增大.A的原子半径在周期表中最小,B原子核外电子有6种不同的运动状态.C元素原子的最外层电子数是次外层电子数的3倍.D元素第一电离能至第四电离能分别是I1=578kJ/mol、I2=1817kJ/mol、I3=2745kJ/mol、I4=11575kJ/mol.E与B可形成正四面体形分子.F的一种同位素的质量数为63,中子数为34.回答下列问题:
A、B、C、D、E、F是元素周期表前四周期中的常见元素,原子序数依次增大.A的原子半径在周期表中最小,B原子核外电子有6种不同的运动状态.C元素原子的最外层电子数是次外层电子数的3倍.D元素第一电离能至第四电离能分别是I1=578kJ/mol、I2=1817kJ/mol、I3=2745kJ/mol、I4=11575kJ/mol.E与B可形成正四面体形分子.F的一种同位素的质量数为63,中子数为34.回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | O2在正极发生氧化反应 | |
| B. | 燃料电池的能量转化率可达100% | |
| C. | 工作一段时间后电解质溶液中OH-的物质的量浓度增大 | |
| D. | 产物为无污染的水,属于环境友好电池 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | CH4$→_{光照}^{Cl_{2}}$HCl$\stackrel{NH_{3}}{→}$NH4Cl | |
| B. | CH2═CH2$→_{催化剂,△}^{H_{2}O}$CH3CH2OH$→_{催化剂,△}^{O_{2}}$CH3CHO | |
| C. | 淀粉$→_{△}^{催化剂}$葡萄糖$→_{△}^{AgNO_{3}溶液}$银镜 | |
| D. | NH3$→_{催化剂}^{O_{2}}$NO$\stackrel{H_{2}O}{→}$HNO3 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题

 .
.查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 常温下,将pH=4的CH3COOH溶液稀释后,溶液中所有离子的浓度均降低 | |
| B. | 温度一定时,向水中滴加少量酸或碱形成稀溶液,水的离子积常数Kw不变 | |
| C. | 3C(s)+CaO(s)=CaC2(s)+CO(g) 在常温下不能自发进行,说明该反应的△H>0 | |
| D. | C(s)+H2O(g)?CO(g)+H2(g)(△H>0),其他条件不变时,升高温度,正反应速率增大,逆反应速率减小,平衡正向移动. |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 煤的干馏和石油的分馏均属化学变化 | |
| B. | 液化石油气和天然气的主要成分都是甲烷 | |
| C. | 煤油可由石油分馏获得,可用作燃料和保存少量金属钠 | |
| D. | 石油裂解可以得到更多的汽油,这种汽油是一种纯净物 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com