
分析 由Na2CO3+Ba(OH)2=BaCO3↓+2NaOH、Na2SO4+Ba(OH)2=BaSO4↓+2NaOH可知,14.51g为碳酸钡、硫酸钡的混合物,加稀硝酸,碳酸钡溶解,最后4.66g为硫酸钡,以此来解答.
解答 解:(1)由BaCO3~Na2CO3~CO2可知,产生的气体在标准状况下的体积为$\frac{14.51g-4.66g}{197g/mol}$×22.4L/mol=1.12L,
答:产生的气体在标准状况下的体积1.12L;
(2)n(BaSO4)=$\frac{4.66g}{233g/mol}$=0.02mol,n(BaCO3)=0.05mol,结合Na2CO3+Ba(OH)2=BaCO3↓+2NaOH、Na2SO4+Ba(OH)2=BaSO4↓+2NaOH可知生成NaOH为0.02mol×2+0.05mol×2=0.14mol,则NaOH溶液的浓度为$\frac{0.14mol}{0.2L}$=0.7mol/L,
答:所得滤液的物质的量浓度为0.7mol/L.
点评 本题考查化学反应的计算,为高频考点,把握物质的性质、发生的反应、物质的量关系等为解答的关键,侧重分析与计算能力的考查,注意原子守恒的应用,题目难度不大.


科目:高中化学 来源: 题型:实验题
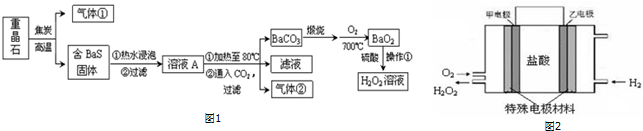
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
| 实验及试剂 | 编号 | 无色NaClO3 溶液用量 | 试管中 溶液颜色 | 淀粉KI 试纸颜色 |
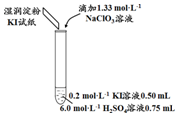 | 1 | 0.05 mL | 浅黄色 | 无色 |
| 2 | 0.20 mL | 深黄色 | 无色 | |
| 3 | 0.25 mL | 浅黄色 | 蓝色 | |
| 4 | 0.30 mL | 无色 | 蓝色 |
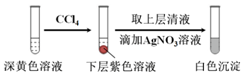
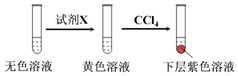
| 编号 | 6.0 mol•L-1 H2SO4溶液用量 | 试管中溶液颜色 | 淀粉KI试纸颜色 |
| 5 | 0.25 mL | 浅黄色 | 无色 |
| 6 | 0.85 mL | 无色 | 蓝色 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 标准状况下,22.4 L的CCl4中C-Cl键数为为4NA | |
| B. | 常温下,1 L 0.1mol•L-1的NH4NO3溶液中氮原子数为0.2 NA | |
| C. | 在反应KIO3+6HI=KI+3I2+3H2O中,每生成3molI2转移的电子数为6 NA | |
| D. | 0.1mol乙酸与0.1mol乙醇反应生成乙酸乙酯的分子数为0.1NA |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
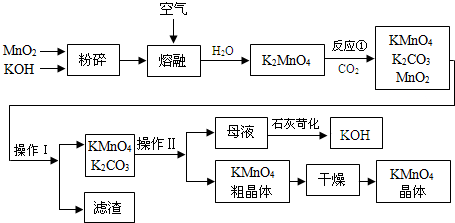

查看答案和解析>>
科目:高中化学 来源: 题型:填空题
 | X | Y | Z | Q |
| 起始(mol) | 0.7 | 1 | ||
| 2min末(mol) | 0.8 | 2.7 | 0.8 | 2.7 |
| 3min末(mol) | 0.6 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 90% | B. | 80% | C. | 45% | D. | 10% |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com